世界の構造生物学および分子モデリング技術市場:技術(計算モデリング、クライオ電顕、質量分析など)、製品タイプ(機器、試薬および消耗品、サービスなど)、ワークフロー段階、用途、エンドユーザー別 – 世界市場予測2025-2032年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
**構造生物学および分子モデリング技術市場の詳細な要約**
**市場概要**
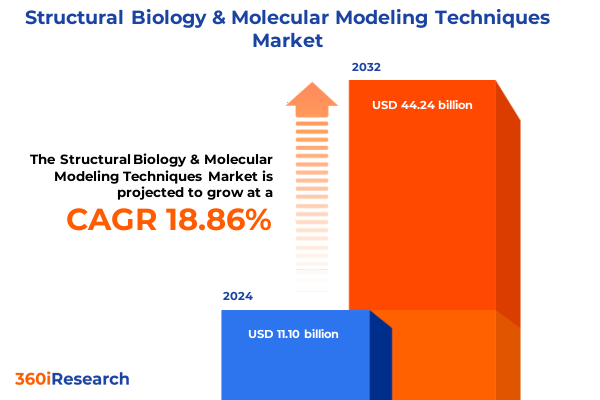
構造生物学および分子モデリング技術市場は、2024年に111.0億米ドルと推定され、2025年には132.0億米ドルに達し、2032年までに年平均成長率(CAGR)18.86%で442.4億米ドルに拡大すると予測されています。この市場は現在、技術的ブレークスルーと多次元的な協業により変革期を迎えています。極低温電子顕微鏡(Cryo-EM)の進歩により、生体分子のほぼ原子分解能での可視化が可能となり、これまで従来の技術では捉えられなかった複雑な集合体の研究が促進されています。同時に、計算モデリングプラットフォームは、人工知能(AI)と高性能コンピューティング(HPC)の力を活用し、かつてない精度で高分子の挙動を予測・シミュレーションできるようになりました。その結果、実験的アプローチとin silicoアプローチの相乗効果がワークフロー効率を合理化し、医薬品開発、タンパク質工学、基礎生物学研究における新たな発見を加速させています。この分野は、これらの方法論的な飛躍に加え、強化されたデータ処理パイプラインとオープンアクセスリポジトリからも恩恵を受けており、共有イノベーションの精神を育んでいます。世界中の研究者は、統合されたソフトウェアスイートを活用して、仮説駆動型実験と反復的な設計プロセスを推進しています。このような技術の融合と異分野間のパートナーシップは、回復力と適応性のあるエコシステムの基盤を築きました。この背景のもと、学術機関から製薬企業に至るステークホルダーは、これらの進歩を活用し、分子レベルの洞察と治療介入の境界を再定義する準備が整っています。
**成長要因**
**技術革新とアクセシビリティの向上**
過去10年間で、構造生物学はパラダイムシフトを経験しました。これは、Cryo-EM装置の普及と、分子モデリングに特化した深層学習アルゴリズムの登場によって加速されています。研究者は現在、単粒子解析により日常的に2Å以下の分解能を達成し、膜タンパク質や大規模複合体の研究を大きく変革しました。同時に、ab initioモデリングはde novo構造予測のための信頼できるツールへと成熟し、時間のかかるX線結晶構造解析やNMR法への依存度を劇的に減少させています。さらに、統合プラットフォームは、トモグラフィーデータと分子動力学シミュレーションをシームレスに組み合わせ、静的な構造と動的なコンフォメーションランドスケープの両方を捉える包括的なモデルを生成しています。クラウドベースのインフラストラクチャはアクセシビリティをさらに向上させ、分散されたチームが大規模なアンサンブルシミュレーションやデータマイニングをリアルタイムで実行することを可能にしています。その結果、実験的証拠がin silico予測を洗練させ、計算的洞察が標的を絞った実験的検証を導くという加速的なフィードバックループがこの分野で生じています。この好循環は、構造解析における精度、速度、スケーラビリティの新たな標準を確立しています。
**多様な技術とエンドユーザーのランドスケープ**
市場のセグメンテーションを詳細に理解することで、複数の側面で異なる技術的軌跡とユーザーニーズが明らかになります。技術別に見ると、X線結晶構造解析(粉末・単結晶)のような確立された手法が、単粒子解析からトモグラフィーに至る極低温電子顕微鏡、そして溶液・固体NMR分光法を含む洗練されたNMR分光法といった急速に拡大する分野と共存しています。計算モデリング自体も、ab initio戦略、ホモロジーフレームワーク、分子動力学シミュレーションに及び、それぞれが生体分子の構造と挙動に関する独自の洞察を可能にしています。製品タイプに目を向けると、研究機関は、高度な機器と、酵素やキットによって差別化された特注の試薬・消耗品、そして専門サービスによってサポートされる包括的なソフトウェアスイートをますます統合しています。アプリケーションは、バイオマーカーの発見や構造機能解析から、リードの特定と最適化が中心となる標的薬物発見経路まで多岐にわたります。エンドユーザーの観点からは、学術研究機関が基礎的な探求を推進し、バイオテクノロジー企業がトランスレーショナルプラットフォームを開拓し、受託研究機関(CRO)がアウトソーシングされた研究を加速させ、大手製薬企業が構造的洞察を臨床パイプラインに応用しています。最後に、ワークフローのステップをマッピングすると、サンプル調製、データ収集(自動または手動)、データ処理、可視化の間でのシームレスな移行の重要性が強調されます。この包括的なセグメンテーションフレームワークは、サンプルスループットの向上から計算パイプラインの洗練に至るまで、構造生物学および分子モデリングの進化するエコシステムを形成する、ターゲットを絞ったイノベーション機会を明確に示しています。
**地域ごとの資金提供と協業エコシステム**
地域ごとのダイナミクスは、構造生物学および分子モデリングにおける研究の優先順位と投資の流れを引き続き形成しています。アメリカ大陸では、確立された製薬ハブと急成長するバイオテクノロジー・クラスターが、ハイスループットのCryo-EMサービス、最先端の計算プラットフォーム、統合された試薬ワークフローへの需要を牽引しています。政府資金によるイニシアティブは、消耗品や高度な計測機器の国内製造を奨励し、自立的なイノベーションサイクルを育んでいます。一方、ヨーロッパ、中東、アフリカの状況は、堅固な学術・産業連携を反映しており、コンソーシアムが集中施設を活用して構造機能研究を加速させています。規制の調和と汎地域的な資金メカニズムは、国境を越えたパートナーシップを促進し、高分解能イメージングセンターや専門的な計算リソースへの共有アクセスを可能にしています。これと並行して、新たな官民モデルが次世代NMR分光法および質量分析装置の設置能力を育成しています。アジア太平洋地域全体では、研究エコシステムが実験的およびin silicoの両方の方法論を急速に採用しています。国家プログラムは、独自の機器開発に多額の資金を投入し、受託研究機関は競争力のあるコスト構造と技術的専門知識を活用して、グローバルなクライアントにサービスを提供しています。クラウドベースのデータ処理ハブと仮想トレーニングプラットフォームは、進化する技術が多様な研究環境全体でシームレスにスケールアップすることを可能にし、グローバルな構造生物学ネットワークにおけるこの地域の極めて重要な役割を強化しています。
**展望と課題**
**2025年関税改正のサプライチェーンと研究継続性への影響**
2025年に実施される新たな米国関税措置は、構造生物学の機器、試薬、消耗品のグローバルサプライチェーンに大きな圧力をかけています。特殊な計測機器や重要な部品に対する輸入関税は、多くの研究機関に、予算目標を維持しつつ研究活動の中断を避けるために、調達戦略の見直しを促しました。同時に、関税によるコスト増は、国内メーカーに酵素、キット、高精度ハードウェアの生産能力拡大を促しました。その結果、研究機関は、コスト変動を緩和するために、自社での試薬合成と戦略的パートナーシップを組み合わせたハイブリッド調達モデルを採用しています。これらの調整は、サプライチェーンの回復力を強化しただけでなく、現地での品質管理とカスタム合成サービスへの投資も促進しました。並行して、先見の明のあるステークホルダーは、予測分析を活用して材料のリードタイムを予測し、調達サイクルを資金調達スケジュールと整合させています。このような積極的な計画は、運用継続性の要となり、進化する貿易政策にもかかわらず、先駆的な構造生物学プログラムのシームレスな進行を保証しています。
**戦略的協業と技術的パイオニア**
この分野のイノベーションを牽引する業界リーダーは、長年の専門知識と先進的なパートナーシップを融合させています。機器のパイオニアは、統合されたCryo-EMワークフローと専用のアッセイキットを含むポートフォリオを拡大し、専門のソフトウェア開発者は、シミュレーションのセットアップと分析を合理化するAI強化モデリングエンジンを提供しています。サービスプロバイダーは、サンプル調製からデータ取得、専門家による解釈、カスタムレポート作成に至るまで、エンドツーエンドの構造決定をサポートするサービスを拡大しました。ハードウェアメーカーとデジタルソリューション企業間の戦略的提携は、バリューチェーンを再構築し、物理的コンポーネントと計算コンポーネントの両方を含む統一されたプラットフォームを創出しています。同時に、試薬メーカーと学術コンソーシアム間の共同事業は、高分解能研究に特化した新規酵素や標識技術の共同開発を促進しています。これらの相乗効果は、速度、精度、再現性の新たなベンチマークを確立し、研究者が複雑な分子ランドスケープを自信を持ってナビゲートできるようにしています。
**構造生物学の進歩を将来にわたって保証するための統合されたイノベーション経路とサプライチェーンの多様化**
このダイナミックな環境で成功するためには、業界リーダーはイノベーション、俊敏性、回復力のバランスをとる多面的な戦略を採用する必要があります。人工知能駆動型プラットフォームへの投資を優先することで、より予測的なモデリングと効率的なデータ解釈が可能となり、研究期間が短縮されます。同時に、サプライヤーネットワークを多様化し、国内生産能力を育成することで、進化する貿易政策や供給途絶の影響を軽減できます。さらに、学術機関や規制機関との異業種連携を構築することで、方法論の標準化を加速し、より広範な技術導入を促進できます。同様に重要なのは、組織がターゲットを絞ったトレーニングプログラムを通じて人材パイプラインを育成し、次世代の研究者が従来の技術と新たな計算手法の両方に習熟し続けることを確実にすることです。これらの提言を企業ロードマップに組み込むことで、リーダーは構造生物学および分子モデリング技術のイノベーションの最前線に立つことができるでしょう。
以下に、目次を日本語に翻訳し、詳細な階層構造で示します。
—
### 目次
1. **レポート範囲**
* 市場セグメンテーションと対象範囲
* 調査対象期間
* 通貨
* 言語
* ステークホルダー
2. **序文**
3. **調査方法**
4. **エグゼクティブサマリー**
5. **市場概要**
6. **市場インサイト**
* 治療開発パイプラインにおけるデノボタンパク質設計のための生成AIモデルの統合
* 困難な膜タンパク質の準原子分解能構造決定を可能にするクライオ電子顕微鏡データ処理の進歩
* 動的巨大分子集合体特性評価のためのNMR分光法と小角X線散乱を組み合わせたハイブリッドモデリングアプローチの開発
* バイオ医薬品研究における大規模分子動力学シミュレーションのためのクラウドベースの高性能計算プラットフォームの採用
* ターゲットベースの薬剤スクリーニングとリード最適化を加速するための機械学習ガイド型リガンドドッキングアルゴリズムの出現
* 大規模なタンパク質間相互作用ネットワークをモデル化するためのAIを用いた統合構造生物学ワークフローの実装
* 酵素反応メカニズムにおける過渡的なコンフォメーション状態を捉えるための時間分解クライオEM技術の組み込み
* 複雑
………… (以下省略)
*** 本調査レポートに関するお問い合わせ ***

構造生物学は、生命現象を分子レベルで深く理解するため、生体高分子、特にタンパク質や核酸、およびそれらの複合体の三次元構造を原子レベルで決定し、その構造が機能、相互作用、そして最終的に生命活動全体にどのように寄与するかを解明する学問分野である。これらの分子の立体構造は、細胞内での役割、他の分子との特異的な結合、疾患の発症メカニズム、さらには薬剤の作用機序に至るまで、生命のあらゆる側面を規定するため、構造情報の解明は現代生命科学の根幹をなす。この構造決定には、主にX線結晶構造解析、核磁気共鳴(NMR)分光法、そして近年飛躍的な発展を遂げたクライオ電子顕微鏡(Cryo-EM)が用いられる。X線結晶構造解析は、結晶化した生体分子にX線を照射し、回折パターンから電子密度マップを構築することで高分解能の構造情報を提供するが、結晶化の困難さが課題となる場合がある。NMR分光法は、溶液中の分子の構造や動態を原子核のスピンを利用して解析し、分子の柔軟性や相互作用を詳細に捉えることができるが、解析可能な分子サイズに限界がある。クライオ電子顕微鏡は、生体分子を急速凍結した非晶質氷中に固定し、電子線を照射して多数の二次元画像を収集・統合することで、結晶化が困難な巨大複合体や膜タンパク質の構造を、生理的条件に近い状態で高分解能で決定することを可能にし、構造生物学に革命をもたらした。
これらの実験的手法によって得られた構造情報を補完し、さらに深い洞察をもたらすのが分子モデリング技術である。分子モデリングは、計算科学的手法を用いて生体分子の構造、動態、相互作用を予測、シミュレーション、および解析する分野であり、実験的に構造決定が困難な分子や、時間スケールでの分子の挙動を理解する上で不可欠なツールとなっている。主要な技術としては、既知の相同タンパク質の構造を鋳型として未知のタンパク質の構造を予測するホモロジーモデリング、分子間の結合様式や親和性を予測する分子ドッキング、そして原子間の相互作用ポテンシャルに基づいて分子の動きを時間的に追跡する分子動力学(MD)シミュレーションなどがある。分子動力学シミュレーションは、タンパク質のフォールディング、リガンド結合時の構造変化、酵素反応における遷移状態など、分子の動的な挙動や柔軟性を原子レベルで可視化し、実験では捉えきれない詳細なメカニズムの解明に貢献する。また、量子化学計算と古典力学計算を組み合わせたQM/MM法は、酵素の活性中心における化学反応など、電子レベルでの詳細な相互作用を解析する際に用いられる。
構造生物学と分子モデリング技術は、互いに密接に連携し、相乗効果を生み出すことで、生命科学研究の進展を加速させている。実験的に決定された構造は、分子モデリングの出発点となり、より正確なシミュレーションや予測を可能にする。例えば、クライオ電子顕微鏡で得られた低分解能の電子密度マップに、ホモロジーモデリングや分子動力学シミュレーションで構築した原子モデルをフィッティングさせることで、高分解能の構造情報を導き出すことが可能となる。逆に、分子モデリングによる予測は、実験計画の立案や結果の解釈に役立ち、特定の変異が構造や機能に与える影響を事前に評価するなど、効率的な研究推進に貢献する。
これらの技術の統合は、特に創薬研究において絶大な影響を与えている。標的タンパク質の三次元構造を解明することで、その活性部位や結合ポケットの形状に基づいた合理的な薬剤設計(構造ベース創薬)が可能となる。分子ドッキングやMDシミュレーションは、数多くの化合物の中から標的タンパク質に効率よく結合する可能性のある候補をin silicoでスクリーニングし、リード化合物の最適化を加速させる。これにより、新薬開発のコストと時間を大幅に削減し、より効果的で副作用の少ない薬剤の創出に貢献している。また、病原体の感染メカニズムの解明、遺伝性疾患の原因となるタンパク質の異常構造の特定、さらにはバイオ燃料生産や環境浄化に利用される酵素の機能改変など、応用範囲は多岐にわたる。近年では、AlphaFoldに代表される人工知能(AI)や機械学習の導入により、アミノ酸配列からタンパク質の三次元構造を高精度で予測する能力が飛躍的に向上し、構造生物学と分子モデリングの新たな時代が幕を開けている。これらの革新的な技術の融合は、生命の複雑なメカニズムの解明を加速させ、医療、農業、環境科学など、人類社会が直面する様々な課題解決への道を拓き続けている。