医薬品トレーサビリティ市場:コンポーネント(ハードウェア、サービス、ソフトウェア)別、テクノロジー(AI・機械学習、バーコード、ブロックチェーン)別、トレーサビリティタイプ別、導入形態別、用途別、エンドユーザー別 – グローバル予測 2025-2032年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
## 医薬品トレーサビリティ市場の現状、推進要因、および展望に関する詳細報告
### 市場概要
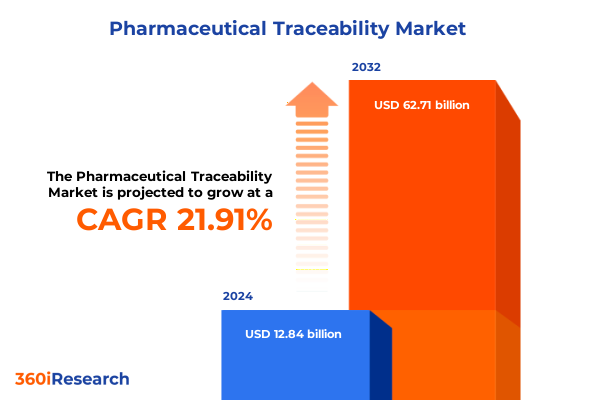
医薬品トレーサビリティ市場は、2024年に128.4億米ドルと推定され、2025年には155.7億米ドルに達すると予測されています。その後、21.91%の年平均成長率(CAGR)で拡大し、2032年には627.1億米ドルに達する見込みです。この成長は、医薬品サプライチェーンの完全性を確保し、患者の安全を保護する上で、**医薬品トレーサビリティ**が不可欠な基盤として認識されていることに起因します。世界市場が規制の複雑さを増す中、製造業者から調剤業者に至るまで、すべてのステークホルダーがエンドツーエンドのシリアル化と電子製品追跡を導入し、サプライチェーンの強化を図っています。
市場は多角的にセグメント化されており、その構成要素はハードウェア、ソフトウェア、サービスに大別されます。ハードウェアには、高スループットのラベリングマシン、堅牢な印刷装置、RFIDタグ、アンテナ、高度なスキャナーが含まれ、パッケージレベルのシリアル化のための物理的基盤を形成します。ソフトウェアセグメントは、シリアル化プラットフォーム、データ管理ソリューション、分析・レポートツールなど多岐にわたり、生データを行動可能な洞察に変えることで高い価値を提供します。さらに、コンサルティング、導入、マネージドサービス、トレーニングなどのサービスが、システムの成功裡な統合と継続的な最適化を支援しています。
技術面では、バーコードベースの識別が依然として多くの既存業務で活用される一方で、RFIDアプリケーションはリアルタイムの位置追跡へと拡大しています。同時に、ブロックチェーンインフラストラクチャとAI/MLモデルがデータの信頼性と予測分析を強化するために導入され、多くの場合、俊敏性とスケーラビリティのためにクラウドネイティブアーキテクチャを介して展開されています。トレーサビリティの種類は、流通、プロセス、製品トレーサビリティを網羅し、原材料の監視から製造プロセス、物流ネットワーク全体での管理連鎖の文書化まで、エンドツーエンドの可視化には同期した機能が求められます。展開モードはクラウドとオンプレミスに分かれ、クラウドプラットフォームは迅速なスケーラビリティを提供する一方、オンプレミス展開は厳格なデータ主権要件に対応します。アプリケーションは偽造品検出、コールドチェーン監視、コンプライアンス報告、サプライチェーン監視など多岐にわたり、**医薬品トレーサビリティ**ソリューションが複数のユースケースに対応していることを示しています。最終的に、政府機関、病院・診療所、製薬メーカー、薬局といったエンドユーザーは、それぞれ独自の規制要件と運用上の制約を抱えており、これらがカスタマイズされたソリューションの必要性を推進しています。
### 推進要因
**医薬品トレーサビリティ**市場の成長を牽引する主要な要因は、厳格化する規制要件、急速な技術革新、そしてサプライチェーンのレジリエンスへの高まるニーズです。
**1. 規制要件の強化:**
世界中で偽造医薬品や基準以下の医薬品に対する懸念が高まる中、各国政府は厳格な規制を導入しています。
* **米国:** 医薬品サプライチェーンセキュリティ法(DSCSA)は、2024年11月27日までに処方薬のパッケージレベルでの追跡を可能にする相互運用可能な電子システムを義務付けており、2025年までにはさらに強化された要件が段階的に導入されます。これにより、取引パートナーはメタデータ形式を標準化し、ブロックチェーン対応の相互運用性への投資を促されています。
* **欧州連合:** 偽造医薬品指令(FMD)は、医薬品に固有の識別子と改ざん防止機能を義務付け、加盟国間の調和を推進し、業界標準を引き上げています。さらに、欧州では2027年までに従来のバーコードからGS1デジタルリンク技術への移行が進み、単一のデジタル識別子内に製品データを埋め込むことで、市販後監視と消費者エンゲージメントが強化されます。
* **その他の地域:** ブラジルにおける同様の規制、中東諸国での国内製造強化、アフリカ諸国での違法取引対策のためのパイロットプログラム、日本やオーストラリアにおける厳格なシリアル化要件などが、地域ごとの**医薬品トレーサビリティ**導入を加速させています。
**2. 技術革新とデジタル変革:**
人工知能(AI)、機械学習(ML)、ブロックチェーン、クラウドコンピューティングといった先進技術の統合が、**医薬品トレーサビリティ**ソリューションの能力を飛躍的に向上させています。
* **AI/MLの活用:** シリアル化ワークフローにAI/MLを組み込むことで、サプライチェーンの混乱を予測し、在庫配分を最適化することが可能になります。SystechのUniSecure artAI™のようなソリューションは、リアルタイムのパッケージアートワーク検証とフォレンジック分析を提供し、偽造品対策を強化しています。
* **ブロックチェーンの成熟:** ブロックチェーンのパイロットプロジェクトは、スケーラブルなエンタープライズイニシアティブへと発展し、不変の監査証跡とステークホルダー間の共有可能な可視性を提供しています。
* **クラウドコンピューティングの普及:** クラウドアーキテクチャは、大量のトランザクションスループットとコンプライアンス報告のための高度な分析をサポートするスケーラブルなデータ管理プラットフォームを提供します。
* **品質管理とトレーサビリティの融合:** 統合された検査システムが、パッケージの完全性を検証しながらシリアル化データを同時に取得できるようになり、エンドツーエンドの**医薬品トレーサビリティ**エコシステムが構築されています。
**3. サプライチェーンのレジリエンスと地政学的圧力:**
地政学的、経済的、公衆衛生上の圧力が高まる中で、サプライチェーンのレジリエンス確保が喫緊の課題となっています。
* **関税の影響:** 2025年に米国が導入した広範な関税措置は、**医薬品トレーサビリティ**ハードウェアおよびサービスの経済性を再構築しています。中国からのAPIには25%、インドからは20%の関税が課され、ドイツ、中国、日本からの医療包装機器には15%の関税が適用されるなど、コスト上昇と調達サイクルの変動を引き起こしています。
* **サプライチェーンの多様化:** これらの関税ショックを緩和するため、多くの組織はより有利な貿易条件を持つ国々(例:ドイツからの包装、カナダからのラベリング部品)への調達拡大を通じてサプライチェーンを多様化しています。これにより、最低コスト追求から、デュアルソーシング、在庫バッファ、段階的な設備投資を重視するレジリエンス志向の調達戦略へとシフトしています。
* **官民連携:** 公的機関と民間企業間の協力イニシアティブは、サプライチェーンの混乱や製品リコールへの迅速な対応を可能にする相互運用可能なネットワークを育成しています。ブロックチェーンベースのトレーサビリティコンソーシアムやデジタルツインフレームワークのパイロットプロジェクトは、原材料調達から製造、流通、最終的な患者への配送まで、エンドツーエンドの可視性を提供しています。
### 展望
**医薬品トレーサビリティ**市場の将来は、継続的な技術革新、戦略的パートナーシップ、そして適応性のある導入戦略によって形成されるでしょう。業界リーダーは、サプライチェーンの継続性を維持し、競争上の優位性を確保するために、多層的かつ積極的なアプローチを採用する必要があります。
**1. 包括的なサプライチェーン監査と投資の優先順位付け:**
組織は、高リスクノードを特定し、複雑性と規制の監視が交差する領域でシリアル化と集約への投資を優先するために、包括的なサプライチェーン監査を実施すべきです。このターゲットを絞ったアプローチにより、資本の効率的な配分が可能となり、コンプライアンスのタイムラインが加速されます。
**2. 柔軟な展開アーキテクチャの採用:**
クラウドのスケーラビリティとオンプレミスの制御のバランスを取る柔軟な展開アーキテクチャを追求することが重要です。これにより、データ主権を確保しつつ、高度な分析機能を活用できます。ハイブリッドモデルは、新たなシリアル化期限や国境を越えた相互運用性イニシアティブなど、変動する量や新たな市場要件に対応した迅速なスケーラビリティを促進します。
**3. 戦略的パートナーシップと共同イノベーション:**
AI、IoT、ブロックチェーンを活用したソリューションを共同で革新するために、テクノロジープロバイダー、インテグレーター、学術機関との戦略的パートナーシップを構築すべきです。コンソーシアム主導のパイロットプロジェクトに参加することで、企業はベストプラクティスを共有し、データ交換プロトコルを標準化し、価値実現までの時間を短縮できます。Antares Vision Groupがギニアビサウ保健省と締結した全国的なトレーサビリティ・検証システム導入契約や、TraceLinkのOrchestration Platform for Universal Solutions (OPUS)のようなプラットフォームは、ターンキーソリューションへの需要と、複雑な規制へのコンプライアンス強化の必要性を示しています。
**4. 労働力トレーニングと変更管理への継続的な注力:**
**医薬品トレーサビリティ**エコシステムは、倉庫業務から規制関連業務まで、複数の機能領域にまたがるため、学際的なトレーニングプログラムとガバナンスフレームワークが、プロセスへの一貫した順守を確保し、トレーサビリティ投資のROIを最大化するために不可欠です。
これらの戦略的推奨事項を組み合わせることで、製薬メーカーや流通業者は、規制の変化や市場の混乱に動的に対応できる、レジリエントで透明性の高いサプライチェーンを構築し、最終的に患者の信頼を保護し、競争上の差別化を実現できるでしょう。
目次
1. 序文
1.1. 市場セグメンテーションとカバレッジ
1.2. 調査対象年
1.3. 通貨
1.4. 言語
1.5. ステークホルダー
2. 調査方法
3. エグゼクティブサマリー
4. 市場概要
5. 市場インサイト
5.1. コールドチェーンバイオ医薬品向けリアルタイムIoTセンサー統合による温度順守と安全性監視の確保
5.2. DSCSAおよびEU FMDフレームワークに基づくグローバル規制順守をサポートするクラウドベースの追跡・追跡ソリューション
5.3. エンドツーエンドの医薬品来歴と偽造防止対策を保証するブロックチェーン対応シリアライゼーションプラットフォーム
5.4. 医薬品サプライチェーンのリスク管理とトレーサビリティを最適化する人工知能駆動型予測分析
5.5. 国境を越えた医薬品流通ネットワーク全体の相互運用性を強化するGS1標準の採用とEPCISイベントデータ共有
5.6. 改ざん検出のために100ミリ秒未満のスキャン速度を達成するよう、中流シリアライゼーションハードウェアが包装ラインを強化
5.7. 病院の入荷物流と調剤時点での患者安全確認を効率化する薬局レベルのアグリゲーションおよびデアグリゲーションプロトコル
5.8. 共有トレーサビリティ台帳採用のための製造業者、流通業者、規制当局間のコンソーシアムベースのブロックチェーン連携
6. 2025年米国関税の累積的影響
7. 2025年人工知能の累積的影響
8. 医薬品トレーサビリティ市場、コンポーネント別
8.1. ハードウェア
8.1.1. ラベリングマシン
8.1.2. 印刷デバイス
8.1.3. RFIDタグ&アンテナ
8.1.4. スキャナー&リーダー
8.2. サービス
8.2.1. コンサルティングサービス
8.2.2. 実装サービス
8.2.3. マネージドサービス
8.2.4. トレーニング&サポート
8.3. ソフトウェア
8.3.1. 分析&レポート作成ツール
8.3.2. データ管理プラットフォーム
8.3.3. シリアライゼーションソフトウェア
9. 医薬品トレーサビリティ市場、テクノロジー別
9.1. 人工知能&機械学習
9.2. バーコード
9.3. ブロックチェーン
9.4. クラウドコンピューティング
9.5. RFID
9.5.1. アクティブ
9.5.2. パッシブ
10. 医薬品トレーサビリティ市場、トレーサビリティタイプ別
10.1. 流通トレーサビリティ
10.2. プロセストレーサビリティ
10.3. 製品トレーサビリティ
11. 医薬品トレーサビリティ市場、展開モード別
11.1. クラウド
11.2. オンプレミス
12. 医薬品トレーサビリティ市場、アプリケーション別
12.1. 認証&検証
12.2. コールドチェーンモニタリング
12.3. 偽造医薬品検出
12.4. 規制報告&コンプライアンス管理
12.5. サプライチェーンモニタリング
13. 医薬品トレーサビリティ市場、エンドユーザー別
13.1. 政府&規制機関
13.2. 病院&クリニック
13.3. 医薬品メーカー
13.4. 薬局
14. 医薬品トレーサビリティ市場、地域別
14.1. 米州
14.1.1. 北米
14.1.2. 中南米
14.2. 欧州、中東、アフリカ
14.2.1. 欧州
14.2.2. 中東
14.2.3. アフリカ
14.3. アジア太平洋
15. 医薬品トレーサビリティ市場、グループ別
15.1. ASEAN
15.2. GCC
15.3. 欧州連合
15.4. BRICS
15.5. G7
15.6. NATO
16. 医薬品トレーサビリティ市場、国別
16.1. 米国
16.2. カナダ
16.3. メキシコ
16.4. ブラジル
16.5. 英国
16.6. ドイツ
16.7. フランス
16.8. ロシア
16.9. イタリア
16.10. スペイン
16.11. 中国
16.12. インド
16.13. 日本
16.14. オーストラリア
16.15. 韓国
17. 競争環境
17.1. 市場シェア分析、2024年
17.2. FPNVポジショニングマトリックス、2024年
17.3. 競合分析
17.3.1. Antares Vision S.p.A.
17.3.2. Avery Dennison Corporation
17.3.3. Axway Software S.A.
17.3.4. Bar Code India Ltd.
17.3.5. Bureau Veritas S.A.
17.3.6. Cognex Corporation
17.3.7. Controlant hf.
17.3.8. Datalogic S.p.A.
17.3.9. Dover Corporation
17.3.10. IBM Corporation
17.3.11. Impinj, Inc.
17.3.12. Logista Pharma S.A.U.
17.3.13. Marchesini Group S.p.A
17.3.14. Markem-Imaje S.A.S.
17.3.15. Mettler-Toledo International Inc.
17.3.16. Movilitas Consulting AG
17.3.17. Optel Group
17.3.18. Oracle Corporation
17.3.19. SAP SE
17.3.20. SATO Holdings Corporation
17.3.21. Scantrust S.A.
17.3.22. Sproxil Inc.
17.3.23. TraceLink Inc.
17.3.24. Zebra Technologies Corporation
17.3.25. Zetes Industries S.A. by Panasonic Corporation
図目次 [合計: 32]
表目次 [合計: 849]
*** 本調査レポートに関するお問い合わせ ***

医薬品トレーサビリティとは、医薬品が製造されてから患者に届くまでの全過程において、その流通経路や状態を追跡・確認できるシステムを指します。これは、医薬品の品質と安全性を確保し、偽造医薬品の流通を阻止するとともに、万が一の製品回収が必要となった際に迅速かつ正確に対応するための極めて重要な基盤となります。医薬品のサプライチェーンは複雑であり、多岐にわたる関係者が関与するため、各段階での情報連携と透明性の確保が不可欠です。このシステムにより、製品の真正性が保証され、患者は安心して医薬品を使用できるようになります。
医薬品トレーサビリティが今日これほどまでに重視される背景には、グローバル化の進展に伴うサプライチェーンの複雑化、そして世界的に深刻化する偽造医薬品問題があります。国境を越えた流通が増加する中で、品質基準の異なる地域からの製品混入リスクや、悪意ある第三者による偽造品の挿入が容易になり、患者の健康を脅かす事態が頻発しています。また、特定のロットに問題が発生した場合、その影響範囲を正確に特定し、迅速に回収措置を講じるためには、製造から流通、そして最終的な供給に至るまでの詳細な記録が不可欠です。こうした喫緊の課題に対応するため、各国政府や国際機関は、医薬品トレーサビリティの強化を強く推進しています。
このトレーサビリティを実現するための主要なメカニズムは、製品一つひとつに固有の識別子を付与する「シリアル化」にあります。具体的には、個々の医薬品包装に製造番号、有効期限、ロット番号、そして固有のシリアル番号を含む二次元バーコード(データマトリックスなど)を印字し、これを流通の各段階で読み取り、情報を記録します。製造業者から卸売業者、そして薬局や医療機関に至るまで、製品が移動するたびにその情報がシステムに登録され、中央データベースや分散型台帳技術(ブロックチェーンなど)を通じて共有・検証されることで、製品の現在地や過去の履歴がリアルタイムで追跡可能となります。これにより、サプライチェーン全体の透明性が飛躍的に向上します。
医薬品トレーサビリティの導入は、多岐にわたる恩恵をもたらします。最も直接的な効果は、患者の安全性の劇的な向上です。偽造品や品質不良品が市場に流通するリスクを最小限に抑え、患者が常に真正で安全な医薬品を受け取れる環境を構築します。また、サプライチェーン全体の可視性が高まることで、在庫管理の最適化や流通プロセスの効率化にも寄与します。さらに、製品回収が必要な際には、問題のあるロットを迅速かつ正確に特定し、対象製品のみを回収することで、公衆衛生上のリスクを限定し、無駄な回収コストを削減できます。これは、医薬品に対する社会全体の信頼を醸成する上でも不可欠な要素となります。
一方で、医薬品トレーサビリティシステムの構築と維持には、いくつかの課題も存在します。初期投資の大きさ、異なるシステム間のデータ連携の複雑さ、そして国際的な標準化の必要性などが挙げられます。特に、グローバルなサプライチェーン全体でシームレスなトレーサビリティを確立するためには、各国・地域の規制や技術仕様の調和が不可欠です。しかし、これらの課題を克服し、AIやIoTといった最新技術を統合することで、トレーサビリティシステムはさらに進化し、より高度なリスク管理や予測分析が可能となるでしょう。医薬品トレーサビリティは、単なる規制遵守の枠を超え、未来の医薬品供給システムの安全性と効率性を支える中核的なインフラとして、その重要性を増し続けています。