世界のヒト化マウスモデル市場の規模、トレンド、シェア、成長、および地域別予測(2025年~2032年)

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
## ヒト化マウスモデル市場の包括的分析:市場シェア、トレンド、成長機会
### 市場概要と予測
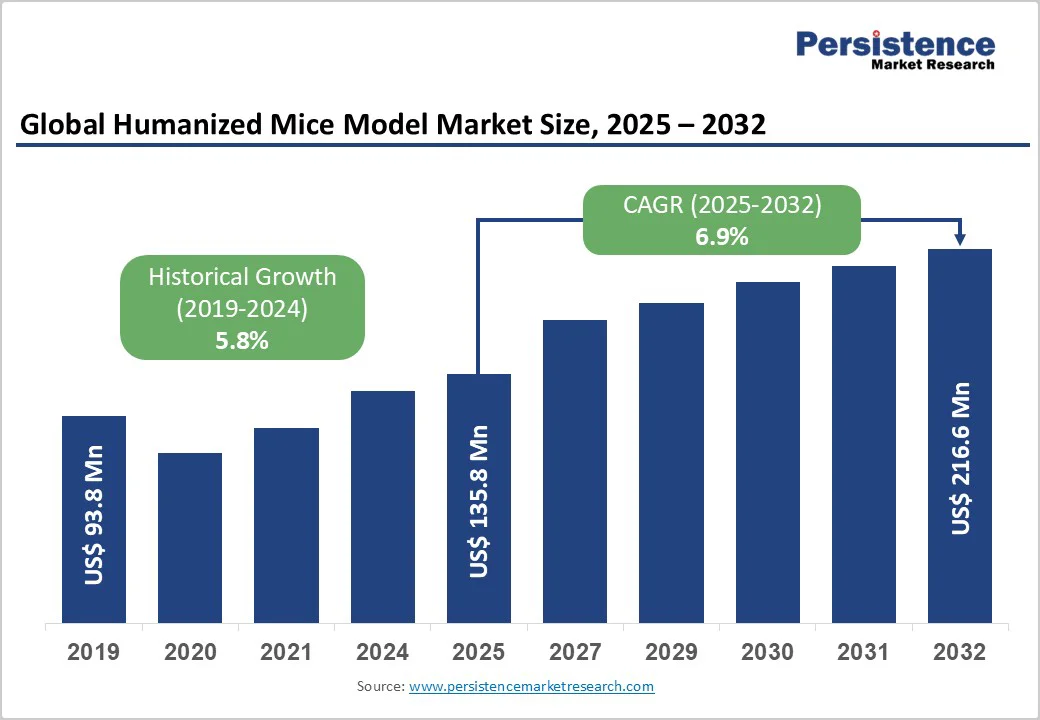
グローバルなヒト化マウスモデル市場は、2025年には1億3,580万米ドル規模に達すると予測されており、2032年までに2億1,660万米ドルへと成長し、予測期間中(2025年~2032年)に年平均成長率(CAGR)6.9%で着実に拡大すると見込まれています。過去の市場成長も堅調で、2019年から2024年のCAGRは5.8%を記録しています。この市場成長は、前臨床研究の需要増加、個別化医療への注力、そして免疫不全マウスモデルの技術進歩が主な原動力となっています。
地域別に見ると、北米が高度な研究インフラと強力なバイオテクノロジー企業の存在により市場を牽引しています。一方、アジア太平洋地域は、生物医学研究の拡大、研究開発(R&D)資金の増加、政府による支援的な取り組みを背景に、最も急速に成長している地域として注目されています。
### 主要な市場ハイライト
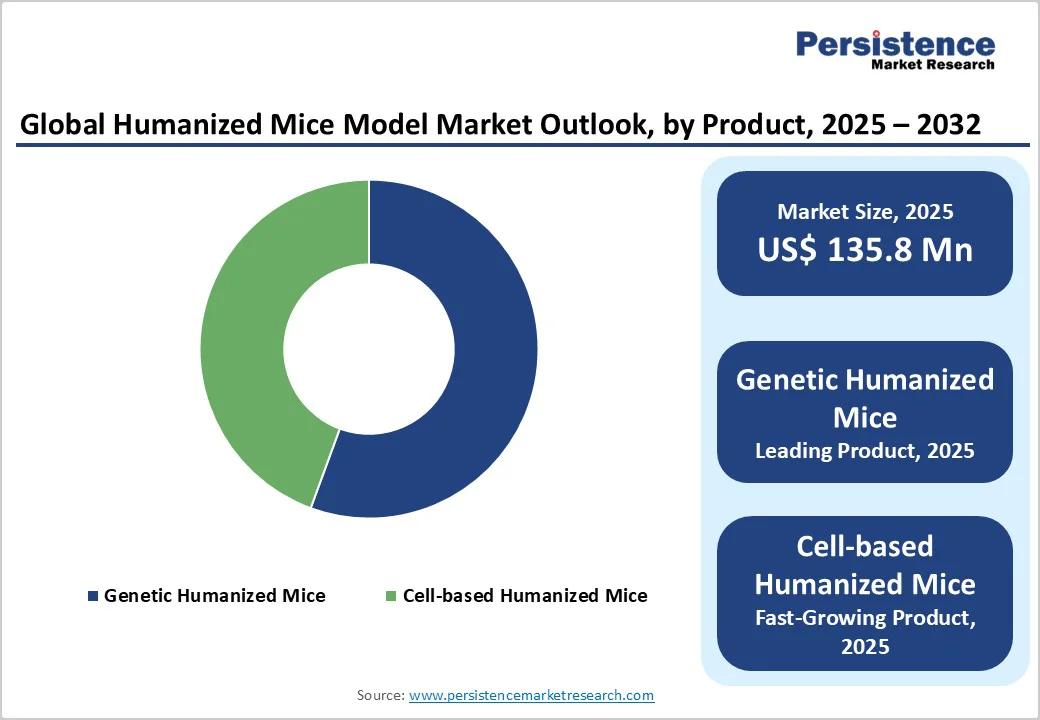
* **主要なモデルタイプ:** 遺伝子改変ヒト化マウスモデルが市場の約55.6%を占め、優位な地位を確立しています。これは、特定のヒト遺伝子機能を正確に再現する能力に優れており、免疫応答、がんの進行、薬物代謝に関する詳細な研究を可能にするためです。CRISPR技術やトランスジェニックエンジニアリングの進歩により、これらのモデルは標的遺伝子治療、免疫腫瘍学、自己免疫疾患研究において幅広く活用されています。
* **主要なアプリケーション:** 腫瘍学分野がヒト化マウスモデル市場の約47.1%を占め、圧倒的なシェアを誇っています。これは、腫瘍の成長、転移、および免疫腫瘍療法を評価する上で、ヒト化マウスモデルが極めて重要な役割を果たすためです。
* **主要な地域:** 北米が世界の収益の約45.2%を占め、市場をリードしています。これは、先進的な生物医学研究インフラ、受託研究機関(CRO)の強力な存在、および製薬・バイオテクノロジー企業からの多大な投資に起因しています。
* **投資計画:** アジア太平洋地域は、R&D施設の拡大、トランスレーショナル研究への資金増加、革新的なヒト化マウスモデル開発のための学術機関と製薬企業間の連携強化により、急速な成長を遂げています。
* **市場の牽引要因:** 個別化医療への需要の高まり、感染症および自己免疫疾患の有病率の増加、免疫腫瘍学におけるヒト化モデルの採用拡大、遺伝子編集および幹細胞移植における技術的進歩が挙げられます。
* **市場機会:** コスト効率の高い次世代トランスジェニックモデルおよびPBMC(末梢血単核球)ベースのモデルの開発、前臨床データのためのAI駆動型分析の統合、再生医療および毒性試験におけるヒト化マウスモデルの応用拡大に向けた戦略的パートナーシップが重要な機会として認識されています。
### 市場の動向
#### 牽引要因:腫瘍学および免疫学研究の需要増加
腫瘍学および免疫学研究の需要増加は、ヒト化マウスモデル市場の主要な牽引要因です。世界保健機関(WHO)によると、がんは依然として主要な死因の一つであり、2022年には推定2,000万件の新規症例と970万人の死亡が報告されています。このような疾病負担の増大は、新しい抗がん剤、免疫療法、標的療法を評価するために、ヒトの生物学的システムをより密接に模倣する前臨床モデルの必要性を加速させています。
これと並行して、自己免疫疾患や感染症の有病率の増加、免疫ベース治療の研究拡大により、免疫学分野も著しい成長を遂げています。米国アレルギー・感染症研究所(NIAID)は、2023会計年度に免疫学および感染症研究に約65.6億米ドルを割り当てました。これらの投資と疾病トレンドの増加は、ヒト免疫応答の正確なin vivo評価を可能にするヒト化マウスモデルの採用を強化し、腫瘍学および免疫学における画期的な進歩を促進しています。ヒト化マウスモデルは、ヒトの複雑な免疫システムや腫瘍微小環境を再現することで、より臨床に近いデータを提供し、創薬プロセスにおける成功率向上に貢献しています。
#### 抑制要因:ヒト化における技術的課題
ヒト化マウスモデル市場における重要な抑制要因の一つは、ヒト化における技術的課題、特にヒト細胞の一貫した高品質な生着を達成することの困難さです。例えば、NSGマウス系統にヒトCD34+造血幹細胞(HSC)を移植した一連の研究では、8週間後に達成されたキメラ率は48.5 ± 21%(n = 26)、41.6 ± 19%(n = 15)と、広範なばらつきを示しています。これは、モデルの再現性と信頼性に大きな影響を与えます。
さらに、ドナー間およびマウス間のばらつきも依然として問題です。あるメラノーマPDX(患者由来異種移植片)ヒト化研究では、同じドナーから移植されたマウスであっても、細胞系統の分布が著しく異なることが指摘されました。これに加えて、一部のヒト化系統(例:NSG-SGM3)では寿命が著しく短縮され、移植後10週から27週の間にすべてのマウスが移植片対宿主病(GvHD)様効果により死亡しました。これらの技術的な不整合は、再現性を損ない、コストを増加させ、前臨床パイプラインの標準化を制限するため、市場での採用とスケーラビリティを抑制する要因となっています。これらの課題は、研究結果の信頼性を低下させ、創薬プロセスの遅延やコスト増大を招く可能性があります。
#### 機会:次世代トランスジェニックおよび多系統モデルの開発
次世代トランスジェニックおよび多系統ヒト化マウスモデルの開発は、前臨床研究および創薬において戦略的な機会をもたらします。政府機関は、動物モデルおよび腫瘍モデルの開発と改良を目的とした資金提供通知(例:NIH PAR-25-273、NCI PAR-24-306、いずれも2024年に発行)を通じて支援の意向を示しています。同時に、CRISPRのような遺伝子編集技術は急速に成熟し、2015年から2022年にかけて数百ものCRISPR関連論文が発表され、その広範な方法論的採用が示されています。FDAが承認したCRISPRベースの治療法exa-celの臨床応用は、ヒトの生物学を再現する精密なin vivoプラットフォームへの投資をさらに正当化します。NIHおよびNIAIDのモデル共有と標準化されたリソースを奨励する政策は、重複を減らし、洗練された系統への幅広いアクセスを促進します。これらの要因が相まって、明確な資金調達経路、CRISPRによるエンジニアリングの加速、およびより強力な共有フレームワークは、技術的障壁を低くし、開発期間を短縮し、次世代トランスジェニック多系統ヒト化モデルをバイオ医薬品および学術投資家にとって魅力的で影響力の大きい機会とし、治療分野全体でのトランスレーショナル予測可能性を向上させます。
### カテゴリー別分析
#### モデルタイプ別:遺伝子改変ヒト化マウスモデルが市場を支配
モデルタイプ別では、遺伝子改変ヒト化マウスモデルが2025年に55.6%のシェアを占め、市場を支配しています。これは、ヒト遺伝子発現と免疫応答を高度に再現する能力に優れているためです。これらのモデルは、特定のヒト遺伝子をマウスゲノムに挿入することで作製され、研究者が複雑な生物学的メカニズム、免疫反応、および疾患の進行をより正確に研究することを可能にします。米国国立衛生研究所(NIH)によると、遺伝子改変マウスの採用は、がん、感染症、免疫学研究において著しく増加しており、ヒト特異的な経路の精密なモデリングを可能にしています。CRISPR-Cas9やトランスジェニック技術の継続的な進歩は、遺伝子ターゲティング効率を向上させ、信頼性とスケーラビリティを高めています。その結果、遺伝子改変ヒト化マウスモデルは、世界中の創薬および前臨床検証研究において、ますます好まれる選択肢となっています。これらのモデルは、ヒトの疾患メカニズムをより忠実に再現できるため、新しい治療法の開発において不可欠なツールとなっています。
#### アプリケーション別:腫瘍学が市場を牽引
アプリケーション別では、がんの負担増加と免疫療法研究での利用拡大により、腫瘍学分野がヒト化マウスモデル市場を牽引しています。世界保健機関(WHO)によると、がんは2022年に約1,000万人の死因となり、世界中で主要な死因の一つとなっています。ヒト化マウスモデルは、ヒトの生理機能に密接に類似したシステムで、腫瘍の成長、免疫回避、および免疫療法への応答を研究することを可能にします。これらのモデルは、免疫チェックポイント阻害剤、CAR-T細胞療法、および標的生物学的製剤の試験に広く利用されています。ヒトの腫瘍微小環境を再現し、臨床転帰を予測する能力は、腫瘍学研究において不可欠なものとなっており、より迅速な薬剤開発と翻訳精度の向上を支援しています。特に、個別化医療の進展に伴い、患者特異的な腫瘍モデルの需要が高まっており、ヒト化マウスモデルはその要求に応える重要なプラットフォームとなっています。
### 地域別インサイト
#### 北米のヒト化マウスモデル市場のトレンド
北米地域は、2025年に45.2%のシェアを占め、世界のヒト化マウスモデル市場を支配しています。これは、その高度な生物医学研究インフラ、製薬およびバイオテクノロジー企業の強力な存在、そして高いR&D投資レベルに起因しています。米国国立衛生研究所(NIH)は、2024年に医療研究に470億米ドル以上を割り当てており、そのかなりの部分が、ヒト化マウスモデルが利用されるがん、免疫学、遺伝子研究などの主要分野に向けられています。
さらに、この地域は、確立された受託研究機関(CRO)、支援的な規制枠組み、およびCRISPRや幹細胞工学のような最先端技術へのアクセスから恩恵を受けています。米国およびカナダの学術機関や研究センターは、業界パートナーと積極的に協力し、さらなるイノベーションを推進しています。これらの要因が総合的に、北米をヒト化マウスモデルの開発と商業化における主要なハブとして位置付けています。
#### 欧州のヒト化マウスモデル市場のトレンド
欧州は、生物医学研究機関の強力なネットワーク、政府資金、およびトランスレーショナル医療への重点により、ヒト化マウスモデル市場における主要な地域です。欧州委員会のHorizon Europeプログラムは、955億ユーロ(2021年~2027年)の予算を持ち、ヒト化モデルに大きく依存するゲノミクス、腫瘍学、免疫学分野の広範な研究を支援しています。ドイツ、英国、フランスなどの国々は、前臨床薬剤開発に焦点を当てた主要な受託研究機関(CRO)や学術協力の拠点となっています。さらに、欧州医薬品庁(EMA)の下での欧州の先進的な規制環境は、倫理的で標準化された動物研究慣行を保証しています。個別化医療と免疫腫瘍学への注力が高まっていることも、ヒト化マウスモデルの採用における欧州の主要ハブとしての地位をさらに強化しています。
#### アジア太平洋地域のヒト化マウスモデル市場のトレンド
アジア太平洋地域は、生物医学研究の急速な拡大、医療費の増加、およびトランスレーショナル研究に対する政府支援の増加により、ヒト化マウスモデル市場で最も急速に成長している地域です。中国、日本、韓国、インドなどの国々は、国内の創薬能力を強化するために、ゲノミクス、腫瘍学、免疫学研究に多大な投資を行っています。例えば、中国の第14次5カ年計画は、バイオテクノロジー革新と前臨床インフラ開発を重視しています。製薬企業と学術機関間の協力の増加、および受託研究機関(CRO)の拡大は、高度なヒト化モデルの利用を加速させています。さらに、研究室インフラの改善、CRISPRベース技術の採用、および個別化医療への需要の高まりが、アジア太平洋地域の急速な市場成長と生物医学研究における世界的競争力を推進しています。
### 競争環境
ヒト化マウスモデル市場の主要企業は、高度でカスタマイズ可能なマウスモデルの開発、規制当局の承認確保、および製薬・バイオテクノロジー企業との戦略的連携に注力しています。主要プレーヤーは、次世代のCD34+および遺伝子改変ヒト化マウスモデルに投資し、CRISPRおよび幹細胞技術を統合して精度とトランスレーショナルな関連性を高めています。いくつかの企業は、パートナーシップ、合併、買収を通じてグローバルな事業展開を拡大し、研究能力とサービスポートフォリオを強化しています。これらの取り組みは、創薬、免疫腫瘍学研究、および個別化医療開発を加速させるとともに、高い再現性と倫理的コンプライアンスを確保することを目的としています。モデル設計とヒト免疫系再構築における継続的な革新は、世界中で信頼性の高い前臨床研究ツールに対する高まる需要を満たす上で中心的な役割を果たしています。
#### 主要な業界動向:
* **2025年9月:** 最近の戦略分析により、次世代薬剤開発におけるC3およびC5ヒト化マウスモデルの重要性が高まっていることが強調されました。研究者らは、ヒト補体系成分を模倣するように設計されたこれらのモデルが、新規治療薬の免疫および炎症反応を評価する上で極めて重要な役割を果たしていると報告しました。補体系は免疫応答の重要な部分であり、そのヒト化は、炎症性疾患や自己免疫疾患の治療法開発に新たな道を開きます。
* **2025年8月:** Taconic BiosciencesとCyagen Biosciencesは、生物医学研究のための前臨床マウスおよびラットモデルへのグローバルアクセスを簡素化することを目的とした戦略的提携を発表しました。このパートナーシップは、Taconicの広範な既製研究モデルのリポジトリとCyagenの高度な遺伝子工学能力を統合することに焦点を当てています。これにより、研究者はより効率的に適切なモデルを入手できるようになります。
* **2025年6月:** Taconic Biosciencesは、免疫腫瘍学、自己免疫疾患、および感染症研究における前臨床研究の信頼性と再現性を向上させるために設計された、huSelect™カスタム免疫系ヒト化プラットフォームの発売を発表しました。この革新により、研究者は特定の実験ニーズに基づいて免疫系ヒト化をカスタマイズできるようになり、ヒト免疫応答のより正確なモデリングが可能になります。
* **2024年5月:** Crown Bioscienceは、先進的な前臨床研究モデルへのアクセスを拡大するため、Shanghai Model Organisms Center(SMOC)とのグローバル協力協定を締結したことを発表しました。このパートナーシップは、Crown Bioscienceの腫瘍学および免疫学研究における広範な専門知識と、SMOCの遺伝子改変マウスモデル開発における強力な能力を組み合わせることを目指しています。
#### ヒト化マウスモデル市場の主要企業:
* Taconic Biosciences
* Biocytogen
* Charles River Laboratories
* The Jackson Laboratory (JAX)
* genOway
* Champions Oncology
* Crown Bioscience
* Horizon Discovery Group
* Ingenious Targeting Laboratory
* Hera BioLabs
* Vitalstar Biotechnology
* Cyagen Biosciences
* その他といった主要な企業が、世界のバイオサイエンス研究および医薬品開発において重要な役割を担っています。
これらの企業は、革新的な遺伝子改変技術や高品質な研究モデル、包括的な前臨床試験サービスを提供することで、難病治療薬の開発や疾患メカニズムの解明に不可欠な基盤を提供しています。特に、個別化医療の進展や新たな治療法の登場に伴い、より高度で多様な研究モデルの需要は高まる一方であり、これらの専門企業が果たす役割は今後ますます重要になるでしょう。彼らの技術とサービスは、次世代の医療を創造するための原動力となっています。
Report Coverage & Structure
エグゼクティブサマリー
- 世界のヒト化マウスモデル市場概要、2025年および2032年
- 市場機会評価、2025年~2032年、US$ Mn
- 主要な市場トレンド
- 将来の市場予測
- プレミアム市場インサイト
- 業界の動向と主要な市場イベント
- PMR分析と推奨事項
市場概要
- 市場範囲と定義
- 市場のダイナミクス
- 推進要因
- 阻害要因
- 機会
- 課題
- 主要トレンド
- マクロ経済要因
- 世界のセクター別見通し
- 世界のGDP成長見通し
- COVID-19影響分析
- 予測要因 – 関連性と影響
付加価値インサイト
- 規制環境
- 製品/サービス導入分析
- バリューチェーン分析
- 主要な取引と合併
- PESTLE分析
- ポーターのファイブフォース分析
世界のヒト化マウスモデル市場見通し:
- 主要なハイライト
- 市場規模 (US$ Mn) および前年比成長率
- 絶対的な$機会
- 市場規模 (US$ Mn) 分析と予測
- 過去の市場規模 (US$ Mn) 分析、2019年~2024年
- 市場規模 (US$ Mn) 分析と予測、2025年~2032年
- 世界のヒト化マウスモデル市場見通し: モデルタイプ別
- はじめに / 主要な調査結果
- 過去の市場規模 (US$ Mn) 分析、モデルタイプ別、2019年~2024年
- 市場規模 (US$ Mn) 分析と予測、モデルタイプ別、2025年~2032年
- 遺伝子改変ヒト化マウス
- 細胞ベースのヒト化マウス
- 市場魅力度分析: モデルタイプ別
- 世界のヒト化マウスモデル市場見通し: アプリケーション別
- はじめに / 主要な調査結果
- 過去の市場規模 (US$ Mn) 分析、アプリケーション別、2019年~2024年
- 市場規模 (US$ Mn) 分析と予測、アプリケーション別、2025年~2032年
- 腫瘍学
- 免疫学&感染症
- 自己免疫疾患
- 再生医療
- 毒性学
- その他
- 市場魅力度分析: アプリケーション別
- 世界のヒト化マウスモデル市場見通し: エンドユーザー別
- はじめに / 主要な調査結果
- 過去の市場規模 (US$ Mn) 分析、エンドユーザー別、2019年~2024年
- 市場規模 (US$ Mn) 分析と予測、エンドユーザー別、2025年~2032年
- 製薬・バイオテクノロジー企業
- 医薬品開発業務受託機関 (CRO)
- 学術・研究機関
- その他
- 市場魅力度分析: エンドユーザー別
世界のヒト化マウスモデル市場見通し: 地域別
- 主要なハイライト
- 過去の市場規模 (US$ Mn) 分析、地域別、2019年~2024年
- 市場規模 (US$ Mn) 分析と予測、地域別、2025年~2032年
- 北米
- 欧州
- 東アジア
- 南アジアおよびオセアニア
- ラテンアメリカ
- 中東・アフリカ
- 市場魅力度分析: 地域別
北米のヒト化マウスモデル市場見通し:
- 主要なハイライト
- 過去の市場規模 (US$ Mn) 分析、市場別、2019年~2024年
- 国別
- モデルタイプ別
- アプリケーション別
- エンドユーザー別
- 市場規模 (US$ Mn) 分析と予測、国別、2025年~2032年
- 米国
- カナダ
- 市場規模 (US$ Mn) 分析と予測、モデルタイプ別、2025年~2032年
- 遺伝子改変ヒト化マウス
- 細胞ベースのヒト化マウス
- 市場規模 (US$ Mn) 分析と予測、アプリケーション別、2025年~2032年
- 腫瘍学
- 免疫学&感染症
- 自己免疫疾患
- 再生医療
- 毒性学
- その他
- 市場規模 (US$ Mn) 分析と予測、エンドユーザー別、2025年~2032年
- 製薬・バイオテクノロジー企業
- 医薬品開発業務受託機関 (CRO)
- 学術・研究機関
- その他
- 市場魅力度分析
欧州のヒト化マウスモデル市場見通し:
- 主要なハイライト
- 過去の市場規模 (US$ Mn) 分析、市場別、2019年~2024年
- 国別
- モデルタイプ別
- アプリケーション別
- エンドユーザー別
- 市場規模 (US$ Mn) 分析と予測、国別、2025年~2032年
- ドイツ
- フランス
- 英国
- イタリア
- スペイン
- ロシア
- その他の欧州地域
- 市場規模 (US$ Mn) 分析と予測、モデルタイプ別、2025年~2032年
- 遺伝子改変ヒト化マウス
- 細胞ベースのヒト化マウス
- 市場規模 (US$ Mn) 分析と予測、アプリケーション別、2025年~2032年
- 腫瘍学
- 免疫学&感染症
- 自己免疫疾患
- 再生医療
- 毒性学
- その他
- 市場規模 (US$ Mn) 分析と予測、エンドユーザー別、2025年~2032年
- 製薬・バイオテクノロジー企業
- 医薬品開発業務受託機関 (CRO)
- 学術・研究機関
- その他
- 市場魅力度分析
東アジアのヒト化マウスモデル市場見通し:
- 主要なハイライト
- 過去の市場規模 (US$ Mn) 分析、市場別、2019年~2024年
- 国別
- モデルタイプ別
- アプリケーション別
- エンドユーザー別
- 市場規模 (US$ Mn) 分析と予測、国別、2025年~2032年
- 中国
- 日本
- 韓国
- 市場規模 (US$ Mn) 分析と予測、モデルタイプ別、2025年~2032年
- 遺伝子改変ヒト化マウス
- 細胞ベースのヒト化マウス
- 市場規模 (US$ Mn) 分析と予測、アプリケーション別、2025年~2032年
- 腫瘍学
- 免疫学&感染症
- 自己免疫疾患
- 再生医療
- 毒性学
- その他
- 市場規模 (US$ Mn) 分析と予測、エンドユーザー別、2025年~2032年
- 製薬・バイオテクノロジー企業
- 医薬品開発業務受託機関 (CRO)
- 学術・研究機関
- その他
- 市場魅力度分析
南アジアおよびオセアニアのヒト化マウスモデル市場見通し:
- 主要なハイライト
- 過去の市場規模 (US$ Mn) 分析、市場別、2019年~2024年
- 国別
- モデルタイプ別
- アプリケーション別
- エンドユーザー別
- 市場規模 (US$ Mn) 分析と予測、国別、2025年~2032年
- インド
- 東南アジア
- ANZ(オーストラリア・ニュージーランド)
- その他の南アジアおよびオセアニア地域
- 市場規模 (US$ Mn) 分析と予測、モデルタイプ別、2025年~2032年
- 遺伝子改変ヒト化マウス
- 細胞ベースのヒト化マウス
- 市場規模 (US$ Mn) 分析と予測、アプリケーション別、2025年~2032年
- 腫瘍学
- 免疫学&感染症
- 自己免疫疾患
- 再生医療
- 毒性学
- その他
- 市場規模 (US$ Mn) 分析と予測、エンドユーザー別、2025年~2032年
- 製薬・バイオテクノロジー企業
- 医薬品開発業務受託機関 (CRO)
- 学術・研究機関
- その他
- 市場魅力度分析
ラテンアメリカのヒト化マウスモデル市場見通し:
- 主要なハイライト
- 過去の市場規模 (US$ Mn) 分析、市場別、2019年~2024年
- 国別
- モデルタイプ別
- アプリケーション別
- エンドユーザー別
- 市場規模 (US$ Mn) 分析と予測、国別、2025年~2032年
- ブラジル
- メキシコ
- その他のラテンアメリカ地域
- 市場規模 (US$ Mn) 分析と予測、モデルタイプ別、2025年~2032年
- 遺伝子改変ヒト化マウス
- 細胞ベースのヒト化マウス
- 市場規模 (US$ Mn) 分析と予測、アプリケーション別、2025年~2032年
- 腫瘍学
- 免疫学&感染症
- 自己免疫疾患
- 再生医療
- 毒性学
- その他
- 市場規模 (US$ Mn) 分析と予測、エンドユーザー別、2025年~2032年
- 製薬・バイオテクノロジー企業
- 医薬品開発業務受託機関 (CRO)
- 学術・研究機関
- その他
- 市場魅力度分析
中東・アフリカのヒト化マウスモデル市場見通し:
- 主要なハイライト
- 過去の市場規模 (US$ Mn) 分析、市場別、2019年~2024年
- 国別
- モデルタイプ別
- アプリケーション別
- エンドユーザー別
- 市場規模 (US$ Mn) 分析と予測、国別、2025年~2032年
- GCC諸国
- エジプト
- 南アフリカ
- 北アフリカ
- その他の中東・アフリカ地域
- 市場規模 (US$ Mn) 分析と予測、モデルタイプ別、2025年~2032年
- 遺伝子改変ヒト化マウス
- 細胞ベースのヒト化マウス
- 市場規模 (US$ Mn) 分析と予測、アプリケーション別、2025年~2032年
- 腫瘍学
- 免疫学&感染症
- 自己免疫疾患
- 再生医療
- 毒性学
- その他
- 市場規模 (US$ Mn) 分析と予測、エンドユーザー別、2025年~2032年
- 製薬・バイオテクノロジー企業
- 医薬品開発業務受託機関 (CRO)
- 学術・研究機関
- その他
- 市場魅力度分析
競合状況
- 市場シェア分析、2024年
- 市場構造
- 市場別競合強度マッピング
- 競合ダッシュボード
- 企業プロファイル (詳細 – 概要、財務、戦略、最近の動向)
- Taconic Biosciences
- 概要
- セグメントと製品
- 主要財務情報
- 市場動向
- 市場戦略
- Biocytogen
- Charles River Laboratories
- The Jackson Laboratory (JAX)
- genOway
- Champions Oncology
- Crown Bioscience
- Horizon Discovery Group
- Ingenious Targeting Laboratory
- Hera BioLabs
- Vitalstar Biotechnology
- Cyagen Biosciences
- その他
- Taconic Biosciences
付録
- 調査方法論
- 調査前提条件
- 頭字語と略語
*** 本調査レポートに関するお問い合わせ ***

ヒト化マウスモデルとは、免疫不全などの特定の遺伝的背景を持つマウスに、ヒト由来の細胞、組織、あるいは遺伝子を導入することで、ヒトの生物学的システムの一部または全体をマウスの体内で再現したモデル動物を指します。この革新的なアプローチは、従来の動物モデルでは十分に再現できなかったヒト特有の生理機能、疾患メカニズム、薬物応答などを研究することを可能にし、医学研究と創薬開発に革命をもたらしました。
従来の実験動物、特にマウスやラットは、その飼育の容易さ、繁殖効率の高さ、遺伝子操作のしやすさから、生物医学研究において不可欠なツールとして広く用いられてきました。しかし、これらの動物モデルは、ヒトとは異なる遺伝的、生理学的、免疫学的特性を持つため、ヒト特有の疾患の病態生理を完全に再現したり、ヒトに特異的な薬剤の有効性や安全性を正確に評価したりすることには限界がありました。例えば、ヒトに感染する特定のウイルスがマウスには感染しない、あるいはヒトの免疫応答とは異なる反応を示すといった問題が頻繁に生じます。このような課題を克服し、より臨床に近い研究を可能にするために開発されたのが、ヒト化マウスモデルなのです。
ヒト化マウスモデルの作製には、まず、宿主となるマウスがヒト由来の細胞や組織を拒絶しないように、重度の免疫不全を持つマウス系統が基盤として用いられます。代表的なものとしては、SCID(重症複合型免疫不全)、NOD/SCID、さらにはより高度な免疫不全を示すNOG(NOD/Shi-scid, IL-2Rγnull)やNSG(NOD-scid IL2Rgamma(null))マウスなどが挙げられます。これらのマウスは、T細胞、B細胞、NK細胞といったリンパ球が機能不全であるため、移植されたヒト細胞に対する免疫応答が極めて抑制されており、ヒト由来の細胞や組織がマウス体内で生着し、機能することが可能になります。
ヒト化マウスモデルには、導入されるヒト由来の要素によって様々な種類が存在します。最も広く用いられているのは、ヒトの造血幹細胞(CD34陽性細胞など)を移植することで、マウス体内でヒトの免疫系を再構築する「ヒト免疫系再構築マウス(HISマウス)」です。このモデルでは、移植された造血幹細胞が分化・成熟し、T細胞、B細胞、NK細胞、マクロファージ、樹状細胞など、多様なヒト免疫細胞がマウスの血液やリンパ器官に出現し、機能的なヒト免疫系を形成します。これにより、ヒトの免疫応答や、免疫系が関与する疾患の研究が可能となります。
また、特定の臓器の機能を再現するために、ヒトの肝細胞を移植した「ヒト肝臓化マウス」も重要なモデルです。このマウスでは、ヒトの肝臓特異的な代謝酵素(例:CYP450)が発現し、ヒト特有の薬物代謝や薬物誘発性肝障害の研究に貢献します。さらに、ヒトの腫瘍細胞株や患者由来の腫瘍組織を移植して作製される「異種移植モデル(Xenograft model)」も、広義のヒト化マウスモデルに含まれます。特に、患者由来の腫瘍組織を直接免疫不全マウスに移植する「患者由来異種移植モデル(PDXモデル)」は、患者個々の腫瘍の遺伝的・病理学的特性をより忠実に再現するため、個別化医療の推進に不可欠なツールとして注目されています。
これらのヒト化マウスモデルは、単一の細胞や組織だけでなく、複数のヒト遺伝子をマウスゲノムに導入することで、特定のヒトタンパク質を発現させたり、ヒトの疾患関連遺伝子変異を再現したりする「遺伝子ヒト化マウス」と組み合わせることで、さらに複雑なヒトの生理学的・病理学的状況を模倣することが可能になります。このように、ヒト化マウスモデルは、その作製技術の進歩とともに、多様な研究ニーズに応える形で進化を続けています。
ヒト化マウスモデルは、その開発以来、多岐にわたる医学研究分野において不可欠なツールとして活用されてきました。その応用範囲は、感染症、がん、免疫疾患、薬物動態・毒性学、そして再生医療研究に至るまで、非常に広範です。
感染症研究においては、ヒトに特異的な病原体の研究に革命をもたらしました。例えば、ヒト免疫系再構築マウスは、ヒト免疫細胞に感染するHIV(ヒト免疫不全ウイルス)の研究に不可欠です。このモデルを用いることで、HIVの感染メカニズム、ウイルス増殖、宿主免疫応答、そして抗HIV薬の有効性をin vivoで評価することが可能となり、新たな治療法の開発に大きく貢献しています。同様に、B型肝炎ウイルス(HBV)やC型肝炎ウイルス(HCV)といったヒト肝細胞に特異的に感染するウイルスについても、ヒト肝臓化マウスモデルがその増殖メカニズムの解明や抗ウイルス薬の効果評価に利用されています。これらのモデルは、ヒトにしか感染しない、あるいはヒトでのみ特異的な病態を示す病原体の研究において、他に類を見ない価値を提供します。
がん研究は、ヒト化マウスモデルの最も活発な応用分野の一つです。ヒト腫瘍細胞を免疫不全マウスに移植する異種移植モデルは、抗がん剤のスクリーニングや有効性評価の標準的な手法として確立されています。特に、患者由来異種移植(PDX)モデルは、患者個々の腫瘍の遺伝子変異や組織学的特徴、薬物感受性を高精度で再現するため、個別化医療の推進に不可欠なツールとなっています。PDXモデルを用いることで、特定の患者に最適な抗がん剤を選択したり、薬剤耐性のメカニズムを解明したりすることが期待されています。さらに、ヒト免疫系再構築マウスにヒト腫瘍を移植したモデルは、免疫チェックポイント阻害剤をはじめとする免疫療法の効果やメカニズムを評価するために用いられ、がん免疫療法の発展に大きく貢献しています。
免疫学研究においても、ヒト化マウスモデルは重要な役割を担っています。ヒト免疫系再構築マウスは、ヒトの免疫応答のメカパスニズム、自己免疫疾患の病態生理、アレルギー反応、移植免疫など、多岐にわたる免疫学的現象を研究するための貴重なプラットフォームを提供します。例えば、ヒトの自己免疫疾患のモデルとして、特定のヒト免疫細胞の異常を再現し、新規治療薬の標的探索や効果検証が行われています。
薬物動態学および毒性学の研究では、ヒト肝臓化マウスがその真価を発揮します。ヒト特異的な薬物代謝酵素(例:CYP450)を発現するこのモデルは、薬物の体内動態、代謝経路、そして薬物誘発性肝障害のリスクをヒトに近い形で評価することを可能にします。これにより、前臨床段階での薬剤の安全性評価の精度が向上し、臨床試験での予期せぬ副作用のリスクを低減することに寄与しています。
再生医療研究においても、ヒト化マウスモデルは重要な役割を担っています。ヒトES細胞やiPS細胞から分化誘導された細胞や組織、あるいは再生医療製品の生着、分化、機能、安全性などをin vivoで評価するために利用されます。例えば、ヒトiPS細胞由来の組織を免疫不全マウスに移植し、その生着や機能回復の度合いを評価することで、再生医療の実用化に向けた研究が進められています。
このように、ヒト化マウスモデルは、その多様な応用を通じて、基礎医学研究から臨床応用まで、幅広い分野で新たな知見をもたらし、疾患の理解と治療法の開発に不可欠な存在となっています。
ヒト化マウスモデルの研究は、絶えず進化を続けており、その動向は、より高度なヒトの生物学的システムを再現することを目指しています。現在のトレンドは、単一のヒト細胞や臓器の機能再現から、複数の臓器システム間の相互作用や、より複雑なヒトの微小環境を模倣することへとシフトしています。
一つの大きな動向は、「より完全なヒト免疫系の再構築」です。初期のヒト免疫系再構築マウスは、主にT細胞やB細胞といったリンパ球の再構築に焦点を当てていましたが、最近では、NK細胞、マクロファージ、樹状細胞、好中球といった自然免疫細胞や骨髄系細胞を含む、より多様なヒト免疫細胞集団の機能的再構築を目指しています。これには、ヒトの胸腺や骨髄といった免疫器官の構造をマウス体内に再現する試みや、サイトカインなどのヒト特異的な免疫調節分子をマウスで発現させる技術の開発が含まれます。このような進歩により、より複雑な免疫応答や、免疫系全体が関与する疾患(例:多発性硬化症、関節リウマチなどの自己免疫疾患)の病態解明や治療法開発が期待されています。
また、「多臓器ヒト化モデル」の開発も重要なトレンドです。これは、例えばヒト肝臓とヒト免疫系、あるいはヒトの腸管と免疫系といった複数のヒト臓器システムを同一のマウス内で再現する試みです。これにより、臓器間の相互作用や、全身性の疾患(例:全身性エリテマトーデス、敗血症)の病態をより忠実に模倣することが可能になります。特に、ヒトの腸内細菌叢(マイクロバイオーム)をマウスに移植する「ヒト化マイクロバイオームマウス」は、腸内環境と免疫系、代謝、神経系との関連を研究する上で極めて有用であり、炎症性腸疾患や肥満、神経疾患など、幅広い疾患への応用が期待されています。
遺伝子編集技術、特にCRISPR/Cas9システムの登場は、ヒト化マウスモデルの作製に新たな可能性をもたらしました。この技術を用いることで、マウスゲノム上の特定の遺伝子をヒト遺伝子に置き換えたり、ヒトの疾患関連遺伝子変異をマウスに導入したりすることが、より簡便かつ高精度に可能となりました。これにより、特定のヒト遺伝子機能の解析や、遺伝性疾患のメカニズム解明に特化した、より精密な「遺伝子ヒト化マウス」の開発が進んでいます。
がん研究においては、患者由来異種移植(PDX)モデルの利用がさらに拡大しています。PDXモデルは、患者個々の腫瘍の多様性を反映し、個別化医療の実現に向けた強力なツールとしてその価値を確立しています。最近では、PDXモデルを基盤として、さらにヒト免疫系を再構築した「ヒト免疫系再構築PDXモデル」の開発が進められており、個別化されたがん免疫療法の効果予測やバイオマーカー探索への応用が期待されています。
さらに、in vitroモデル(例:オルガノイド、臓器チップ)との連携も重要な動向です。オルガノイドは、3次元的に培養されたヒト由来のミニ臓器であり、ヒト化マウスモデルと組み合わせることで、より多角的な情報を提供できます。例えば、オルガノイドで初期スクリーニングを行い、有望な候補をヒト化マウスモデルで検証するといったハイブリッドアプローチは、創薬研究の効率化と精度向上に貢献すると考えられています。
これらの技術的進歩は、ヒト化マウスモデルが単なる疾患モデルを超え、ヒトの複雑な生理学的プロセスや疾患のメカニズムをより深く理解するための、高度な研究プラットフォームへと進化していることを示しています。
ヒト化マウスモデルの未来は、個別化医療の実現、創薬研究の加速、そして難治性疾患の克服に向けた希望に満ちています。しかし同時に、技術的限界や倫理的課題への対応も求められます。
最も大きな展望の一つは、個別化医療への貢献です。患者由来の細胞や組織を用いたヒト化マウスモデル、特にPDXモデルは、患者個々の疾患特性を反映した「アバター」として機能します。これにより、特定の患者にとって最適な治療法をin vivoで事前に評価したり、薬剤耐性のメカニズムを解明したりすることが可能になります。将来的には、患者の診断時に採取された生体サンプルからヒト化マウスモデルを迅速に作製し、治療薬の選択や治療計画の最適化に役立てる「プレシジョンメディシン」の実現に不可欠なツールとなるでしょう。これは、無駄な治療を避け、患者のQOL向上に大きく貢献する可能性を秘めています。
創薬研究においても、ヒト化マウスモデルはますますその重要性を増していくと考えられます。前臨床段階での薬剤の有効性・安全性評価の精度が向上することで、臨床試験での成功率が高まり、新薬開発のコストと時間の削減に寄与します。特に、ヒト特異的な薬剤ターゲットの探索や、ヒト特有の薬物動態・毒性プロファイルの評価において、その価値は計り知れません。AIやビッグデータ解析技術との融合により、ヒト化マウスモデルから得られる膨大なデータを効率的に解析し、新たな治療標的の同定や薬剤候補の最適化を加速させることも期待されます。
難治性疾患の研究においても、ヒト化マウスモデルは重要な役割を果たすでしょう。現在、有効な治療法が確立されていない神経変性疾患、心血管疾患、代謝性疾患など、非感染症・非がん領域への応用がさらに拡大することが予想されます。特に、ヒトの脳や神経系を再現する「ヒト脳化マウス」や、ヒトの心臓組織を移植したモデルの開発は、これらの疾患の病態解明と新規治療法開発に新たな道を開く可能性があります。
しかしながら、ヒト化マウスモデルには依然として限界と課題が存在します。マウスとヒトの生理学的・解剖学的な違いは完全に克服できるものではなく、完全なヒトの複雑なシステムをマウスの体内で再現することは極めて困難です。マウスの寿命やサイズ、代謝速度の違いは、ヒトの慢性疾患や長期的な薬物効果の研究において制約となることがあります。これらの限界を克服するためには、さらなる技術革新や、in vitroモデル(オルガノイド、臓器チップ)や計算科学モデルとの連携を強化し、多角的なアプローチで研究を進めることが重要です。
倫理的課題もまた、ヒト化マウスモデルの展望を語る上で避けては通れません。ヒト細胞や組織の利用、特にヒトの造血幹細胞や脳細胞をマウスに移植することに対しては、倫理的な議論が常に伴います。ヒトの意識や認知機能がマウスに付与される可能性(現状では極めて低いと考えられているものの、将来的な懸念)や、ヒトと動物の境界を曖昧にする可能性について、社会的な合意形成と厳格な倫理的ガイドラインの遵守が不可欠です。動物福祉への配慮も当然ながら重要であり、動物実験の3R原則(Replacement, Reduction, Refinement)に基づいた適切な管理と利用が求められます。
これらの課題を乗り越え、技術的進歩と倫理的配慮のバランスを保ちながら研究を進めることで、ヒト化マウスモデルは、今後も生命科学研究と医療の発展に多大な貢献をしていくことでしょう。その進化は、人類が直面する様々な疾患の克服に向けて、希望の光を灯し続けています。