フラグメントベース創薬市場(製品タイプ:フラグメントライブラリ、スクリーニング技術、ソフトウェアツール;手法:生物物理学的手法、非生物物理学的手法;用途:腫瘍学、中枢神経系(CNS)疾患、感染症、心血管疾患、代謝性疾患、その他)– 世界の産業分析、規模、シェア、成長、トレンド、および予測、2025-2035年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
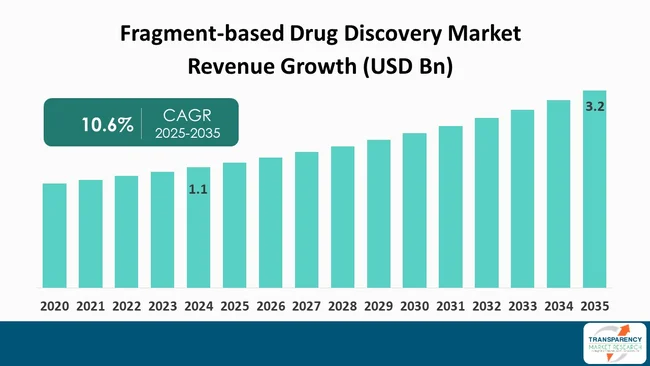
フラグメントベース創薬(FBDD)市場は、2025年から2035年までの予測期間において、著しい成長が見込まれています。この市場は、2024年には11億米ドルの評価額に達し、2025年から2035年にかけて年平均成長率(CAGR)10.6%で成長し、2035年末には32億米ドルを超える規模に拡大すると予測されています。
アナリストの視点
フラグメントベース創薬(FBDD)は、バイオ医薬品業界が、がん、免疫疾患、中枢神経系(CNS)疾患の発生率増加に対応するため、パイプラインの再供給という大きな圧力に直面している中で、急速に勢いを増しています。特許の崖やコスト圧力により、企業は新規の化学的開始点を発見し、タンパク質間相互作用やアロステリックポケットといった困難なターゲットに対して差別化を図る道を模索せざるを得ません。画期的な医薬品や希少疾病用医薬品に対する規制上のインセンティブ、そしてファーストインクラスのメカニズムへのアクセスを提供するベンチャーキャピタル投資が、メカニズム駆動型設計のプロジェクトを推進しています。これらの要因が複合的に作用し、創薬戦略は新しい生物学へのアクセスを可能にし、ポートフォリオの持続可能な再構築を可能にするFBDDプログラムへとシフトしています。
FBDDの採用は、高磁場NMR、シンクロトロンX線結晶構造解析、そしてますます主流となるクライオ電子顕微鏡(cryo-EM)の普遍的な利用可能性によって推進されています。これらは、困難なターゲットにおける構造決定の迅速化とヒット確認を可能にします。生物物理学、構造決定、医薬品化学における確立されたアウトソーシング専門CROは、小規模企業にとっての障壁を低減する一方で、大規模組織は疾患クラスごとにFBDDのプレイブックを標準化しています。企業内のデータレイクは、SAR(構造活性相関)、構造、生物物理学データを統合し、意思決定の質を高め、設計・合成・試験サイクルを短縮して、扱いやすいADME(吸収、分布、代謝、排泄)プロファイルを提供しています。同時に、より効果的なトランスレーショナルバイオマーカーアプローチと早期段階の薬理モデルがターゲット選択のリスクを低減し、FBDDをファーストインクラスおよびベストインクラスのプログラムにとって最適なアプローチにしています。
最近の進展としては、共有結合性フラグメントや求電子性フラグメントの使用増加、物理的に列挙されたフラグメント拡張の成長、水の熱力学や自由エネルギー摂動を適用する物理学に基づいたスコアリングなどが挙げられます。Cryo-EMは、大規模複合体を超えて、困難な膜タンパク質におけるリガンド結合能力を示すようになり、マイクロ結晶X線および連続結晶構造解析は、構造に基づいた精密化のスループットを向上させています。ネイティブ質量分析、SPR(表面プラズモン共鳴)、MST(マイクロスケール熱泳動)は、弱い結合体のトリアージや協調性のマッピングのために、ますます組み合わせて使用されています。研究者たちは、ルールオブファイブを超える困難な空間、マクロサイクル、アロステリック結合体を探求しているほか、選択的なE3リガーゼやネオ基質結合体を発見することで、FBDDをRNAターゲット、分子接着剤、分解剤の開始点へと拡張しています。
競争は、個々の資産ではなく、プラットフォームの創出と能力の積み重ねによって定義されています。例えば、企業は自動化された生物物理学的スクリーニング、迅速な並列合成、リアルタイムの構造フィードバックを組み合わせた包括的なFBDDスタジオを設立しています。設計サイクルを最適化するために、cryo-EMや高磁場NMR、結晶化のためのマイクロ流体、FAIR(Findable, Accessible, Interoperable, and Reusable)データ標準を備えたクラウドネイティブELN(電子実験ノート)への投資が行われています。パートナーシップも進化しており、リスク共有型の創薬共同研究、ライセンスオプション契約、検証済みターゲットに基づくデータルームパートナーシップなどが含まれます。スクリーニングモダリティや共有結合性ウォーヘッド化学が特許化され、専門CROネットワークを通じて地域拡大が追求され、構造生物学、計算化学、医薬品設計におけるクロス・トレーニングによってチームのスキルアップが図られています。
フラグメントベース創薬(FBDD)の概要
フラグメントベース創薬(FBDD)は、新しい医薬品のリードとして、低分子量の化学フラグメントを発見・開発する新しい創薬戦略です。広大なライブラリから大規模分子をスクリーニングするハイスループットスクリーニングとは対照的に、FBDDは、結合親和性が低い場合でもターゲットタンパク質領域に効率的に結合できる、はるかに短いフラグメントを使用します。構造生物学と医薬品化学を適用して、より活性が高く選択的な薬物候補を構築し、それによって新しい治療薬を発見するプロセスを非常に効率的にし、その後これらのフラグメントを最適化します。
FBDDの基礎は、従来の創薬アプローチと比較して、化学空間をより効果的に探索できるという事実にあります。フラグメントは通常の薬物様分子よりもはるかに小さいため、原子あたりの結合効率が優れており、親和性と特異性を高めるために、より頻繁に混合または変更することができます。これは、タンパク質間相互作用や新しい結合部位など、より大きな分子を持つ治療が困難な薬物ターゲットにとって特に有用です。
核磁気共鳴(NMR)、X線結晶構造解析、クライオ電子顕微鏡は、FBDDにとって不可欠な技術です。これらの構造技術は、弱いフラグメント結合を検出し、そのタンパク質ターゲットへの結合を視覚化することを可能にします。フラグメントから構造情報が得られると、医薬品化学者は、その構造を基に、フラグメントをより複雑な分子へと成長または連結させ、薬理学的特性を向上させることができます。計算手法と生物物理学的スクリーニングは、フラグメントの選択と最適化においてフラグメント研究を支援し、創薬プロセスを促進することもできます。
FBDDは、多くの承認薬や多数の臨床候補の拡大を支援してきました。FBDDは、これまでドラッガブルではないと考えられていたターゲットに対しても、新規作用機序を持つ新しい分子を発見することを可能にします。FBDDは、フラグメントスクリーニング、構造生物学、合理的設計の組み合わせを含む、現代の主要な創薬アプローチです。
市場の推進要因
1. FBDDの高い効率性と多様性:
フラグメントベース創薬(FBDD)の高い効率性は、FBDD産業の拡大を促進する原動力となっています。大規模分子の従来のハイスループットスクリーニング方法と比較して、FBDDは管理しやすいが効率の高い、より小さなフラグメントライブラリを使用します。フラグメントは化学空間でより効率的にスクリーニングされ、科学者は少ない労力で創薬のための洞察に富んだ開始点を見つけることができます。これにより、初期創薬における時間、コスト、複雑さが節約され、FBDDは製薬およびバイオテクノロジー企業にとって好ましい選択肢となっています。
柔軟性もFBDDのもう一つの重要な強みであり、市場での人気を促進しています。ターゲット同定中にスクリーニングされたフラグメントは、目に見えて柔軟であり、より強力で選択的な、より高度な大規模分子へと操作、追加、または伸長することができます。FBDDは、NMR分光法、X線結晶構造解析、クライオ電子顕微鏡、計算モデリングなど、さまざまな分析技術に影響を与えます。これらの各技術は、フラグメント結合を迅速に確認し、詳細な構造分析を可能にし、三次元構造に関するより良い理解を可能にします。生物物理学的技術と計算技術を同時に組み合わせることで、FBDDは両方の技術の利点を融合させ、確立されたターゲットと新興ターゲットの両方にとって価値のあるものとなり、それによって創薬の可能性を高めます。
効率と柔軟性の向上に加えて、小分子発見に依存する創薬企業は、パイプラインを多様化するためにFBDDプラットフォームをますます採用しています。FBDDは、創薬スケジュールを短縮し、ファーストインクラスの薬物候補を特定する機会を増やします。これにより、FBDDはイノベーション主導型産業における比較差別化デバイスとして投資する価値のあるものとなっています。
2. フラグメントライブラリの革新:
フラグメントベース創薬(FBDD)市場の主要な推進要因の一つは、フラグメントライブラリの開発です。フラグメントライブラリは、サイズが小さく、創薬の出発点となる低分子量化学物質です。当初、フラグメントライブラリは多様性に乏しいものでしたが、より化学的および構造的に多様で、薬物類似性が最適化されたライブラリを開発するための努力がなされてきました。これらの改善は、高品質のフラグメントヒットを選択する可能性を高め、創薬プロセスを加速し、より効果的にします。
現代のフラグメントライブラリの設計は、化学的多様性の増加と化学空間のカバレッジの拡大に重点を置いています。新しい足場、三次元形状、改善された物理化学的特性を組み込むことにより、これらのライブラリは、科学者が新規または困難なターゲットに対して結合能力を持つフラグメントを選択することを可能にします。この幅広い適用可能性により、FBDDはドラッガブルではないタンパク質にも利用できるようになります。
もう一つの注目すべき進展は、共有結合性フラグメント、RNAターゲット用フラグメントライブラリ、天然物様フラグメントで構成されたライブラリなど、特殊なフラグメントライブラリの出現です。これらのライブラリは、困難な生物学的ターゲットに対して選択的で強力なリードを成功裏に特定する可能性を高めます。新たに作成されているライブラリのタイプには、人工知能と機械学習を使用してフラグメントの性能を予測する計算設計ライブラリが含まれており、スクリーニング結果を向上させ、リードまでの時間を短縮することが期待されています。
これらの新しいフラグメントライブラリの継続的な開発を通じて、フラグメントスクリーニングはより信頼性の高いものとなり、より一貫した方法で高価値のヒット生成候補を生み出す態勢が整っています。その結果、早期段階での脱落が減少し、候補が臨床開発に進む可能性が高まります。これらの新しいライブラリとその成功した応用は、FBDDを優れた創薬戦略として強化し、ステークホルダーがFBDDへの投資とパートナーシップを増やすことを確実にします。このように、新しいタイプのフラグメントライブラリは、世界のフラグメントベース創薬市場の成長と成功の顕著な推進要因となっています。
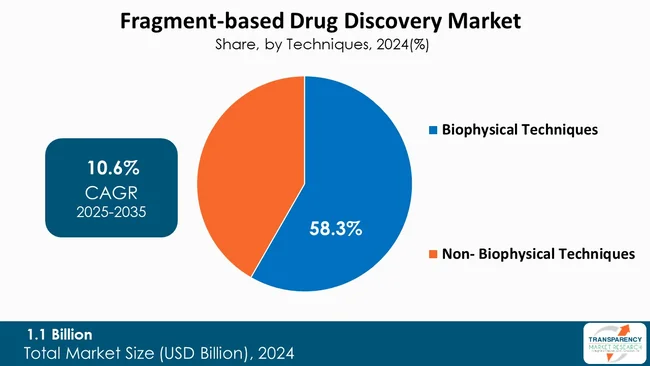
生物物理学的技術が世界のFBDD市場をリード
生物物理学的技術は、ターゲットタンパク質との弱いフラグメント結合を特定するこれらの方法の高い感度と精度により、フラグメントベース創薬(FBDD)市場を支配しています。核磁気共鳴(NMR)、表面プラズモン共鳴(SPR)、等温滴定熱量測定(ITC)、X線結晶構造解析などの方法は、初期創薬に不可欠なヒットフラグメントを正確に特定し、検証することを可能にします。これらの方法は、詳細な構造情報と結合情報を提供し、フラグメントを強力なリード化合物へと迅速に最適化することを可能にします。生物物理学的アプローチは、取り扱いが簡単で、堅牢で、再現性があり、複雑な生物学的ターゲットの測定を可能にするため、FBDD操作にとって選択される技術です。
フラグメントベース創薬市場の地域別展望
最新のフラグメントベース創薬市場分析によると、北米が2024年に市場を支配しました。これは、十分な資金を持つ研究機関の存在、多数のバイオテクノロジーおよび製薬企業の存在、そして創薬中に使用される技術への資金投入の増加によるものです。この地域は、公的および私的機関からの支援的な資金調達を享受しており、継続的なイノベーションと新しいスクリーニング技術、構造生物学ツール、フラグメントライブラリの組み込みを促進しています。さらに、北米は、FBDDプログラムを支援する熟練した研究者、学術機関、契約研究機関(CRO)が集中しています。規制支援と精密医療への強力な焦点は、採用を強化し、FBDD産業における北米の世界的リーダーとしての地位をさらに強化すると見られています。
フラグメントベース創薬市場の主要プレイヤー分析
フラグメントベース創薬市場のプレイヤーは、プレミアムフラグメントライブラリへの投資、生物物理学的プラットフォームと計算プラットフォームの組み合わせ、パートナーシップ関係の構築、CROパートナーシップの構築などの戦術を採用しています。彼らはまた、早期段階のリスク共有モデル、スクリーニング技術に関するIPの開発、および創薬パイプラインを加速するためのエンドツーエンドFBDDプラットフォームの構築にも注力しています。
世界のフラグメントベース創薬産業で事業を展開する主要プレイヤーには、Thermo Fisher Scientific Inc.、Astex Pharmaceuticals、Domainex、Beactica Therapeutics AB、Charles River Laboratories、Evotec International GmbH、Sprint Bioscience、Structure Based Design, Inc.、Sygnature Discovery Limited、Malvern Panalytical Ltd.、Vernalis (R&D) Limited (HitGen Inc.)、SARomics Biostructures、WuXi AppTec、Schrödinger, Inc.、ZOBIO BVなどが挙げられます。これらの各プレイヤーは、企業概要、財務概要、事業戦略、製品ポートフォリオ、事業セグメント、最近の動向などのパラメータに基づいて、フラグメントベース創薬市場調査レポートでプロファイルされています。
フラグメントベース創薬市場の主要な動向
2025年4月、EnamineとPohang Accelerator Laboratory (PAL) は、共同創薬をさらに支援するための覚書(MoU)を締結しました。この覚書は、フラグメントベース創薬とヒット最適化における研究開発への相互のコミットメントを記述しており、両者は、迅速な化学開発システムと高度なスクリーニング技術を組み合わせることで、フラグメントヒットの特定から高度なリードまでのシームレスな経路を提供するために、迅速な化学開発を推進することを目指しました。
フラグメントベース創薬市場のスナップショット
* 2024年の市場規模:11億米ドル
* 2035年の予測値:32億米ドル
* CAGR:10.6%
* 予測期間:2025年~2035年
* 過去データ:2020年~2023年
* 定量的単位:10億米ドル
市場セグメンテーション
このレポートでは、以下のセグメントに基づいて市場を詳細に分析しています。
* 製品タイプ:
* フラグメントライブラリ
* スクリーニング技術
* ソフトウェアツール
* 技術:
* 生物物理学的技術:
* NMR分光法
* X線結晶構造解析
* 質量分析
* キャピラリー電気泳動
* その他(蛍光偏光、表面プラズモン共鳴など)
* 非生物物理学的技術
* アプリケーション:
* 腫瘍学
* 中枢神経系(CNS)疾患
* 感染症
* 心血管疾患
* 代謝性疾患
* その他(炎症性および自己免疫疾患など)
* エンドユーザー:
* 契約研究機関(CRO)
* 製薬およびバイオテクノロジー企業
* 学術および研究機関
* 対象地域:
* 北米
* ヨーロッパ
* アジア太平洋
* ラテンアメリカ
* 中東・アフリカ
* 対象国:
* 米国、カナダ
* ドイツ、英国、フランス、イタリア、スペイン、オランダ
* 中国、オーストラリア、インド、日本、韓国、ASEAN
* ブラジル、メキシコ、アルゼンチン
* GCC諸国、南アフリカ
このレポートは、セグメント分析と地域レベルの分析を含んでいます。さらに、定性分析には、推進要因、抑制要因、機会、主要トレンド、バリューチェーン分析、主要トレンド分析が含まれています。競争環境は、競争マトリックスと企業プロファイルセクションで構成され、企業概要、製品ポートフォリオ、販売拠点、主要子会社または販売代理店、戦略と最近の動向、主要財務情報が記載されています。レポート形式は電子版(PDF)とExcelで提供され、カスタマイズおよび価格はリクエストに応じて利用可能です。
よくあるご質問
Q: 2024年における世界のフラグメントベース創薬市場の規模はどのくらいでしたか?
A: 2024年、世界のフラグメントベース創薬市場は11億米ドルの価値がありました。
Q: 2035年には、世界のフラグメントベース創薬産業の規模はどのくらいになる見込みですか?
A: 世界のフラグメントベース創薬産業は、2035年末までに32億米ドルを超える規模に達すると予測されています。
Q: フラグメントベース創薬市場を牽引する要因は何ですか?
A: 製薬R&D投資の増加、従来の創薬手法に対するFBDDの効率性と多様性、フラグメントライブラリ設計の進歩、X線結晶構造解析、NMR、クライオEMなどのスクリーニング技術の発展、そして新規治療法への需要の高まりなどが、フラグメントベース創薬市場の拡大を牽引する要因の一部です。
Q: 予測期間中、世界のフラグメントベース創薬産業のCAGR(年平均成長率)はどのくらいになりますか?
A: CAGRは2025年から2035年にかけて10.6%になると予測されています。
Q: 世界のフラグメントベース創薬市場における主要なプレーヤーはどこですか?
A: Thermo Fisher Scientific Inc.、Astex Pharmaceuticals、Domainex、Beactica Therapeutics AB、Charles River Laboratories、Evotec International GmbH、Sprint Bioscience、Structure Based Design, Inc.、Sygnature Discovery Limited、Malvern Panalytical Ltd、Vernalis (R&D) Limited (HitGen Inc.)、SARomics Biostructures、WuXi AppTec、Schrödinger, Inc.、およびZOBIO BVです。
本レポートは、「グローバル・フラグメントベース創薬市場」に関する包括的な市場分析と予測を提供しており、2020年から2035年までの期間を対象としております。
市場概要では、フラグメントベース創薬の定義、全体像、そして市場を形成する主要なダイナミクスについて解説しております。具体的には、市場の成長を促進する「推進要因」、成長を抑制する「抑制要因」、および将来的な「機会」が詳細に分析されております。また、この期間における市場収益予測(US$ Bn)も提示されております。
主要な洞察として、本レポートは多岐にわたる視点から市場を深く掘り下げております。これには、主要国・地域における医療費の動向、フラグメントベース創薬における技術的進歩、バイオフィジカル技術の最新トレンド、主要地域・国における規制状況が含まれます。さらに、ポーターの5フォース分析やPESTLE分析といった戦略的フレームワークを用いて市場構造と外部環境を評価し、新規市場参入者向けの市場参入戦略、エンドユーザーの主要な購買指標、業界の主要イベント(提携、協力、製品承認、M&Aなど)、そして主要競合他社が提供する製品・サービスのベンチマーク分析も提供されております。
グローバル市場分析と予測は、複数のセグメントにわたって詳細に行われております。
製品タイプ別では、フラグメントライブラリ、スクリーニング技術、ソフトウェアツールの各カテゴリに焦点を当て、それぞれの導入と定義、主要な発見・開発、2020年から2035年までの市場価値予測、および市場魅力度分析が提供されております。
技術別では、バイオフィジカル技術と非バイオフィジカル技術に分類されます。バイオフィジカル技術には、NMR分光法、X線結晶構造解析、質量分析、キャピラリー電気泳動、その他(蛍光偏光、表面プラズモン共鳴など)が含まれ、これらの技術ごとの分析が行われております。
用途別では、腫瘍学、中枢神経系(CNS)疾患、感染症、心血管疾患、代謝性疾患、その他(炎症性疾患、自己免疫疾患など)といった主要な治療領域におけるフラグメントベース創薬の応用が分析されております。
エンドユーザー別では、医薬品受託研究機関(CROs)、製薬・バイオテクノロジー企業、学術・研究機関が主要なセグメントとして特定され、それぞれの市場動向が詳細に評価されております。
これらの各セグメントにおいて、導入と定義、主要な発見・開発、2020年から2035年までの市場価値予測、および市場魅力度分析が網羅的に提供されております。
地域別のグローバル市場分析と予測も本レポートの重要な部分でございます。北米、欧州、アジア太平洋、ラテンアメリカ、中東・アフリカの各地域について、主要な発見、2020年から2035年までの市場価値予測、および地域別の市場魅力度分析が提供されております。さらに、各地域内では、製品タイプ、技術、用途、エンドユーザー、そして特定の国やサブ地域(例:北米では米国、カナダ;欧州では英国、ドイツ、フランスなど;アジア太平洋では中国、インド、日本など)ごとの詳細な市場価値予測と魅力度分析が実施されております。
競争環境のセクションでは、市場における主要プレーヤーの競争マトリックス(企業のティアと規模別)、2024年時点の企業別市場シェア分析が提示されております。また、Thermo Fisher Scientific Inc.、Astex Pharmaceuticals、Domainex、Beactica Therapeutics AB、Charles River Laboratories、Evotec International GmbH、Sprint Bioscience、Structure Based Design, Inc.、Sygnature Discovery Limited、Malvern Panalytical Ltd、Vernalis (R&D) Limited (HitGen Inc.)、SARomics Biostructures、WuXi AppTec、Schrödinger, Inc.、ZoBio BVといった主要企業の詳細なプロファイルが含まれております。各企業プロファイルには、企業概要、財務概要、事業戦略、および最近の動向が網羅されており、市場の競争構造を深く理解するための貴重な情報源となっております。
表一覧
表01:世界のフラグメントベース創薬市場価値(10億米ドル)予測、製品タイプ別、2020年~2035年
表02:世界のフラグメントベース創薬市場価値(10億米ドル)予測、技術別、2020年~2035年
表03:世界のフラグメントベース創薬市場価値(10億米ドル)予測、生物物理学的技術別、2020年~2035年
表04:世界のフラグメントベース創薬市場価値(10億米ドル)予測、用途別、2020年~2035年
表05:世界のフラグメントベース創薬市場価値(10億米ドル)予測、エンドユーザー別、2020年~2035年
表06:世界のフラグメントベース創薬市場価値(10億米ドル)予測、地域別、2020年~2035年
表07:北米のフラグメントベース創薬市場価値(10億米ドル)予測、国別、2020年~2035年
表08:北米のフラグメントベース創薬市場価値(10億米ドル)予測、製品タイプ別、2020年~2035年
表09:北米のフラグメントベース創薬市場価値(10億米ドル)予測、技術別、2020年~2035年
表10:北米のフラグメントベース創薬市場価値(10億米ドル)予測、生物物理学的技術別、2020年~2035年
表11:北米のフラグメントベース創薬市場価値(10億米ドル)予測、用途別、2020年~2035年
表12:北米のフラグメントベース創薬市場価値(10億米ドル)予測、エンドユーザー別、2020年~2035年
表13:欧州のフラグメントベース創薬市場価値(10億米ドル)予測、国/サブ地域別、2020年~2035年
表14:欧州のフラグメントベース創薬市場価値(10億米ドル)予測、製品タイプ別、2020年~2035年
表15:欧州のフラグメントベース創薬市場価値(10億米ドル)予測、技術別、2020年~2035年
表16:欧州のフラグメントベース創薬市場価値(10億米ドル)予測、生物物理学的技術別、2020年~2035年
表17:欧州のフラグメントベース創薬市場価値(10億米ドル)予測、用途別、2020年~2035年
表18:欧州のフラグメントベース創薬市場価値(10億米ドル)予測、エンドユーザー別、2020年~2035年
表19:アジア太平洋地域のフラグメントベース創薬市場価値(10億米ドル)予測、国/サブ地域別、2020年~2035年
表20:アジア太平洋地域のフラグメントベース創薬市場価値(10億米ドル)予測、製品タイプ別、2020年~2035年
表21:アジア太平洋地域のフラグメントベース創薬市場価値(10億米ドル)予測、技術別、2020年~2035年
表22:アジア太平洋地域のフラグメントベース創薬市場価値(10億米ドル)予測、ビーズベースアッセイ別、2020年~2035年
表23:アジア太平洋地域のフラグメントベース創薬市場価値(10億米ドル)予測、用途別、2020年~2035年
表24:アジア太平洋地域のフラグメントベース創薬市場価値(10億米ドル)予測、エンドユーザー別、2020年~2035年
表25:ラテンアメリカのフラグメントベース創薬市場価値(10億米ドル)予測、国/サブ地域別、2020年~2035年
表26:ラテンアメリカのフラグメントベース創薬市場価値(10億米ドル)予測、製品タイプ別、2020年~2035年
表27:ラテンアメリカのフラグメントベース創薬市場価値(10億米ドル)予測、技術別、2020年~2035年
表28:ラテンアメリカのフラグメントベース創薬市場価値(10億米ドル)予測、生物物理学的技術別、2020年~2035年
表29:ラテンアメリカのフラグメントベース創薬市場価値(10億米ドル)予測、用途別、2020年~2035年
表30:ラテンアメリカのフラグメントベース創薬市場価値(10億米ドル)予測、エンドユーザー別、2020年~2035年
表31:中東・アフリカのフラグメントベース創薬市場価値(10億米ドル)予測、国/サブ地域別、2020年~2035年
表32:中東・アフリカのフラグメントベース創薬市場価値(10億米ドル)予測、製品タイプ別、2020年~2035年
表33:中東・アフリカのフラグメントベース創薬市場価値(10億米ドル)予測、技術別、2020年~2035年
表34:中東・アフリカのフラグメントベース創薬市場価値(10億米ドル)予測、生物物理学的技術別、2020年~2035年
表35:中東・アフリカのフラグメントベース創薬市場価値(10億米ドル)予測、用途別、2020年~2035年
表36:中東・アフリカのフラグメントベース創薬市場価値(10億米ドル)予測、エンドユーザー別、2020年~2035年
*** 本調査レポートに関するお問い合わせ ***

フラグメントベース創薬(FBDD)は、低分子量の化合物である「フラグメント」を足がかりとして、より強力で選択性の高い薬剤候補を効率的に見つけ出す創薬手法です。従来のハイスループットスクリーニング(HTS)が比較的大きな分子を対象とするのに対し、FBDDは分子量が小さく、構造的に単純なフラグメントからスタートします。これにより、少ない数の化合物で広範な化学空間を探索し、タンパク質との結合部位を効率的に特定できる特徴があります。具体的には、数百から数千種類の多様な低分子量フラグメントライブラリを構築し、NMR(核磁気共鳴)、X線結晶構造解析、表面プラズモン共鳴(SPR)といった物理的手法で標的タンパク質との弱い結合を検出します。結合が確認されたフラグメントは、その結合様式に基づき、連結(複数のフラグメントを繋ぎ合わせる)、伸長(フラグメントを結合部位内で拡張する)、またはマージング(異なるフラグメントを統合する)といった戦略で最適化され、最終的にリード化合物へと発展させます。
FBDDの利点は多岐にわたります。第一に、小さなフラグメントは少ない数で広範な化学空間を効率的に探索できるため、従来のスクリーニングでは見逃されがちな新規骨格の発見に繋がりやすいです。第二に、フラグメントはタンパク質との結合効率が高く、高いヒット率が期待できます。第三に、X線結晶構造解析などの構造生物学的手法と組み合わせることで、フラグメントとタンパク質の結合様式を原子レベルで詳細に理解し、合理的な分子設計を可能にします。これにより、結合親和性だけでなく、選択性や薬物動態特性を考慮した最適化が効率的に進められます。また、低分子量からスタートするため、最終的な薬剤候補の分子量を適切に制御しやすく、難溶性タンパク質や結合ポケットが小さい標的にも適用しやすいというメリットがあります。
フラグメントベース創薬を支える関連技術も重要です。タンパク質とフラグメントの複合体構造を決定するX線結晶構造解析やNMRといった構造生物学的手法は、FBDDの根幹をなします。また、ドッキングシミュレーションや分子動力学シミュレーションなどの計算化学は、フラグメントの結合予測や最適化戦略の立案を支援し、スクリーニングの効率化に貢献します。さらに、フラグメントの連結や伸長を効率的に行うための有機合成化学の技術、特にクリックケミストリーのようなモジュラー合成手法も不可欠です。近年では、フラグメントライブラリの設計や結合予測、最適化パスの探索において、AIや機械学習の活用も進められており、FBDDのさらなる発展が期待されています。