臨床試験の世界市場(2025-3034):フェーズ別(第1段階、第2段階、第3段階、第4段階)、試験デザイン別、治療領域別、サービス種類別

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
2024年の世界臨床試験市場は590億米ドル。同市場は、2025年の624億米ドルから2034年には989億米ドルまで、年平均成長率5.2%で成長すると予測されています。慢性疾患の有病率の増加と、それに伴う新規治療薬に対する需要の増加が市場を牽引する主な要因です。
がん、糖尿病、心血管疾患などの慢性疾患の罹患率の増加は、最先端で効果的な治療法の必要性を浮き彫りにし、臨床研究の拡大と患者の転帰の改善を目的とした新規の治療法や介入に対する需要を促進しています。慢性疾患は現在、ほぼすべての国で成人の主な死因となっており、今後10年間でさらに17%増加すると予測されています。世界全体では、成人の約3人に1人が複数の慢性疾患に苦しんでいます。
慢性疾患の増加に伴い、効果的な治療法に対する需要も高まり、製薬会社やバイオテクノロジー企業は新薬の開発に取り組んでいます。ClinicalTrials.govの報告によると、2023年5月17日現在、世界全体で合計452,604件の臨床試験が登録され、64,838人が積極的に参加者を募集しています。これは、2021年初頭に記録された約365,000件の臨床試験から大幅に増加しました。このように世界中で実施される臨床試験の数が増加していることが、予測期間中の市場成長を促進する主な要因です。
さらに、研究開発費の増加と様々な段階にある医薬品の増加は、臨床試験市場の成長を大幅に押し上げると予想されます。製薬・バイオ医薬品業界の研究開発費は世界で最も高い水準にあります。そのため、様々なバイオ医薬品企業や製薬企業が臨床試験サービスをアウトソーシングするようになり、市場の成長が促進されるでしょう。例えば、医薬品評価研究センター(CDER)は2024年中にアメリカだけで50の新薬を承認しました。
このように、臨床試験のアウトソーシングには定評のある開発業務受託機関が必要であり、予測期間中の市場成長を促進すると予想されます。さらに、技術革新と個別化医療が標的療法の開発を加速させていることも、業界の成長を加速させる重要な要因となっています。
臨床試験とは、新規の検査や治療法を評価し、ヒトの健康状態への影響を評価する大規模な研究です。医薬品、医療装置、その他の生物学的製剤を含む医療介入を試験するために、個人が自発的に臨床試験に参加します。臨床試験は4段階で実施され、開始前に承認が必要です。臨床試験にはあらゆる年齢の人が参加できます。
臨床試験市場の動向
さまざまな慢性疾患や感染症の出現と蔓延は、研究者にとって、こうした疾患の早期発見、予防、治療のための新たな診断検査、ツール、ワクチン、薬剤を開発するためのいくつかの課題と好機を生み出しています。したがって、慢性疾患の有病率の増加とこれらの疾患に対する意識の高まりは、効果的な薬剤に対する需要を急増させ、ひいては臨床試験の需要を増加させ、予測期間中の市場成長を後押ししています。
アジア太平洋地域は、患者数の増加、試験実施コストの低さ、規制遵守の容易さ、試験実施場所としてトップクラスの臨床機関が利用可能であることから、臨床試験を実施するためのホットスポットであると認識されています。例えば、アジアにおける臨床試験の総支出は、EUやアメリカよりも約30〜40%低いと指摘されています。したがって、臨床試験サービスに対する需要は、アジア諸国のような新興経済国で非常に高まっています。
例えば、2017年から2021年の間に、アジア太平洋地域、アメリカ、EU5で70,000件以上の臨床試験が新たに登録されました。アジア太平洋地域の寄与が最も大きく、50%以上の臨床試験が登録され、次いでアメリカ(29%)、EU5(17%)となっています。このように、アジア太平洋地域の新興国で実施される臨床試験の数が増加していることから、臨床試験市場は楽観的な市場成長が見込まれます。
さらに、革新的な医薬品を開発するための研究開発投資が増加していることも、予測期間中の市場成長を促進する見込みです。一部の大手製薬企業や医療機器企業は、研究活動への支出を大幅に増やすと指摘されています。例えば、2023年には、製薬業界の研究開発費は世界全体で3,000億米ドルを超えました。
さらに、製薬会社は、経営成績を最大化するために研究開発アウトソーシング戦略を採用する傾向が強まっています。このような戦略的イニシアチブは、柔軟性と技術進歩のための競争力、高度に熟練した専門家による専門的サービス、経済的安定性をこれらの企業に提供します。
さらに、政府からの有利な資金援助が市場の成長を後押しする見込みです。政府の資金提供機関と製薬会社は、複数の臨床試験に資金を提供するようになっています。例えば、英国では、政府が医学研究評議会(MRC)や国立保健研究所(NIHR)などの組織を通じて健康関連の研究を後援しています。また、NCRI(National Cancer Research Institute:国立がん研究所)を通じて、国家レベルでのがん研究のコーディネートも行っています。同様に、アメリカではNCI(国立がん研究所)ががん試験全体の約半分に資金を提供しています。このように、政府や非政府組織からの資金提供の増加が市場の成長を支えています。
臨床試験市場の分析
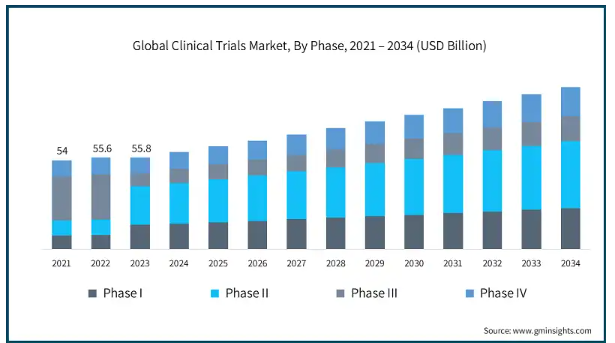
フェーズに基づき、市場はフェーズI、II、III、IVに分類されます。第III相セグメントは2024年に293億米ドルを占めます。2021年、2022年、2023年はそれぞれ264億米ドル、273億米ドル、275億米ドル。
医薬品開発における重要な貢献、資源配分、確認的役割のため、第III相臨床試験が市場を支配しています。これらの臨床試験は、医薬品の有効性と安全性を大規模に検証するために実施され、通常、多くの地理的な場所や施設に分散した数千人の被験者で構成されます。第Ⅲ相臨床試験の目的は、前臨床試験で収集された、薬剤が有益であり、安全であり、目的の適応症に対して効果的な治療を提供するという主要な証拠を決定し、確認することです。
FDAやEMAなどの規制機関は、販売許可を与える前に十分な第III相のエビデンスを必要とするため、臨床開発において最も時間とコストのかかる段階となります。
さらに、製薬企業やバイオテクノロジー企業は、医薬品の市場可能性を確立する上で不可欠な役割を果たすため、第III相試験に多大なリソースを割いています。このような臨床試験では、大規模な処理を適切に行うために、精巧な物理的施設やCROとの提携が頻繁に必要となるため、市場の高成長に寄与しています。
臨床試験市場は試験デザインに基づき、介入試験、観察試験、拡大アクセス試験に区分されます。2024年は介入試験分野が市場を支配し、予測期間中のCAGRは5%で成長すると予測されています。
インターベンショナル試験は、この試験に関連する様々な利点により、かなりの市場成長が見込まれます。その利点には、疾病が発症する前に曝露に関するデータが得られるため、想起バイアスが排除されることなどが挙げられます。
さらに、介入研究は、新しい介入の効率を測定するための強化された方法を提供するため、エビデンスの最も高い階層ピラミッドの一つと考えられています。
同様に、この研究はほとんどの臨床試験で使用されており、その結果、需要が増加し、セグメント開発が進んでいます。
この試験は、医薬品や生物製剤に続いて、臨床処置や装置介入試験の大半で実施されるため、将来的にはこのような試験の需要が高まります。
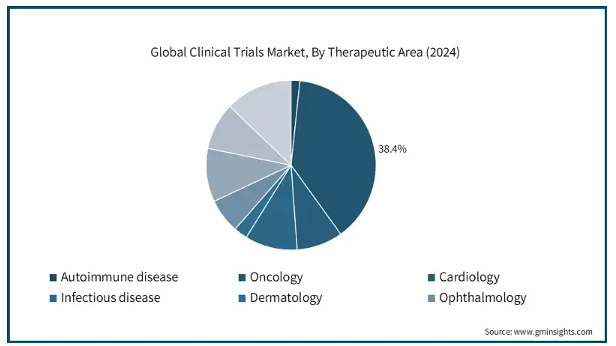
臨床試験市場は治療分野に基づき、自己免疫疾患、腫瘍学、循環器学、感染症、皮膚科学、眼科学、神経学、血液学、その他の治療分野に区分されます。がん分野は2024年の市場シェア38.4%で市場を支配し、予測期間中の年平均成長率は5.9%と予測されています。
癌の有病率の増加により、スポンサーは癌をより良く管理するための様々な治療法や医療装置の開発に注力せざるを得なくなり、その結果、臨床試験の数が増加し、癌治療のための様々な薬剤が発見されています。
例えば、WHOによると、2050年には新たながん患者が3,500万人を超えると予測されており、これは2022年の推定2,000万人から77%増加します。このようながん負担の増加は、新たながん治療に対する需要を高め、その結果、がん治療薬を開発するための研究開発投資が増加します。2023年には、アメリカFDAは11のファースト・イン・クラスの治療薬を含む60以上のがん治療薬の承認を発行しました。
したがって、癌の有病率の増加と抗癌剤の開発と承認の増加は、癌分野の成長を促進します。
さらに、新規診断技術の開発に対するメーカーの注目が高まっていることも、がん領域の成長性に影響を与えると予想されます。
サービスの種類別では、臨床試験市場はアウトソーシングサービスとインハウスサービスに二分されます。2024年の市場規模はアウトソーシングサービスが圧倒的に大きく、2034年には673億米ドルに達すると予測されています。
製薬企業、バイオテクノロジー企業、医療機器企業は、効率化とコスト削減のため、治験管理をCROに委託しています。臨床試験実施の複雑化もアウトソーシングの必要性を高めています。
加えて、国際共同治験を実施する企業の増加に伴い、CRO サービスの利用が不可欠となっています。これらの企業は、被験者の登録や薬事承認プロセスをより簡単かつ迅速に行うため、世界各地に拠点を設けているからです。
さらに、製薬企業は、研究開発アウトソーシング戦略を採用することで、業務パフォーマンスを最大化する傾向が強まっています。臨床試験のアウトソーシングは、これらの企業にとって、柔軟性と技術的進歩に対する競争力、高度に熟練した専門家による専門的サービス、経済的安定性を提供します。また、巨大な実験設備に伴う設備投資を削減し、中核となる専門技術に集中することができます。
さらに、中小のバイオ医薬品企業は大規模な臨床試験を実施するのに必要なリソースを持たない傾向があり、その結果、複雑な規制上のハードルやリソースの配分を管理するためにCROに大きく依存しています。
北米の臨床試験市場は、2024年の世界市場で54.6%のシェアを占めました。アメリカ市場の2021年の市場規模は270億米ドル。2023年には、アメリカは278億米ドルの収益で北米市場を支配し、2022年の277億米ドルから成長しました。
市場の大幅な成長は、北米地域の製薬・バイオテクノロジー企業の密度が高いことに起因しています。例えば、アメリカの製薬業界は世界の製薬業界の最先端を走っており、世界の医薬品売上高のほぼ半分を占めています。
さらに、精密医療や生物製剤を含む医薬品開発の複雑化により、バイオ医薬品企業や製薬企業は臨床試験に投資する必要があります。
さらに、臨床試験を促進するための政府機関からの多額の資金援助が市場の成長を助けています。例えば、2023年のNIHによる臨床研究資金は約189億米ドルでした。
さらに、さまざまな疾患の治療のために臨床試験をアウトソーシングする製薬企業やバイオテクノロジー企業への注目度が高まっていることも、北米市場の成長を後押しすると予想されます。
ヨーロッパの臨床試験市場は、2034年末までに242億米ドルに達すると予測されています。
市場成長の背景には、疾病負担の増加、早期診断と効果的な治療に対する意識の高まりがあります。さらに、同地域には主要な市場参入企業が存在することも、同地域の成長拡大に拍車をかけています。
さらに、同地域における研究開発費の増加が市場成長をさらに促進します。例えば、欧州製薬団体連合会(EFPIA)によると、医薬品の研究開発費は2022年の488億米ドルから2023年には510億米ドルに増加しました。
また、創薬や関連する研究調査に対する政府からの資金援助も、市場成長を促進する顕著な要因のひとつです。
ドイツ臨床試験市場は今後数年間で急成長が見込まれます。
同国における臨床試験件数の増加、研究開発投資の高さ、同国における大手製薬企業や医療機器企業の存在といった装置が市場の成長を促進しています。
情報筋によると、2021年にドイツは医薬品の研究開発に約90億米ドル以上を投資しました。これは欧州のどの国よりも多い。同様に、2024年には、ドイツの医薬品イノベーションに約125億米ドルの支出が計画されています。
このような医薬品研究開発への高額投資は、市場の成長を後押しすると予想されます。
アジア太平洋地域の臨床試験市場は、予測期間中に5.7%のCAGRを示すと予測されています。
この大幅な成長は、同地域で心疾患、癌、糖尿病などの慢性疾患の有病率が増加していることに起因しています。
さらに、地域の疾病負担、製薬企業やバイオテクノロジー企業によるアウトソーシングの増加、アウトソーシングへのパラダイムシフトが、アジア太平洋諸国の市場収益に好条件をもたらしています。
患者数が多く低コストであることから、インド、中国、日本、韓国、ASEAN諸国などへの臨床試験のアウトソーシングが増加しており、アジア太平洋地域の市場を後押ししています。
中国の臨床試験市場は予測期間中に著しい成長が見込まれます。
同国の高い市場成長の背景には、医療研究に対する政府の強力な支援、製薬およびバイオテクノロジー産業の拡大、革新的な治療に対する需要の増加があります。
同国は、多数のCROが存在すること、アメリカやヨーロッパに比べて価格が安いことから、特に腫瘍学、神経学、希少疾患などの早期臨床試験の主要拠点になりつつあります。
また、大規模な患者プール、デジタルヘルス技術、有利な規制政策なども市場成長を後押しする要因となっています。
ブラジルの臨床試験市場は、ラテンアメリカ市場で大きな成長が見込まれます。
高度に熟練した労働力と低い運営コストにより、同国は臨床試験に理想的です。また、多様な患者層が世界の製薬・バイオ企業を惹きつけています。
さらに、同国の規制環境の改善と研究開発への注力の高まりは、グローバル製薬企業にとっての魅力を高めています。
南アフリカ臨床試験産業は、中東・アフリカ臨床試験市場において急速な成長が見込まれています。
同国は医療インフラが発達しており、患者数が多く、運営コストが低いため、グローバル製薬企業にとって魅力的です。
さらに、南アフリカは規制の枠組みが整っており、新規治療薬の開発に注力する傾向が強まっていることも、同国の市場を牽引しています。
臨床試験市場シェア
臨床試験業界で事業を展開する主要企業には、Charles River Laboratories、Laboratory Corporation of America Holdings、IQVIA、ICON plc、Syneos Healthなどがあります。これら上位5社で世界市場の約38%を占めています。これらの市場プレーヤーは、より多くの収益を生み出し、市場競争に耐えるために、合併、買収、革新的なサービスの開発・発売、提携などの戦略に注力しています。
例えば、2021年9月、IQVIAはNRx Pharmaceuticalsとの提携を発表しました。この提携は、効果的な規制当局への対応に向けた医療情報とファーマコビジランスサービスの提供に重点を置いたもので、NRx社はIQVIAのCOVID-19に関する領域経験、データ分析、資産を活用し、ZYESAMIのEUA(緊急時使用承認)の可能性を支援することができます。
パレクセル・インターナショナル・コーポレーション、ヴィーダ・クリニカル・リサーチ、メドスペースなどの他の企業も、競争力を高めるため、サービス承認や発売を含む様々な戦略的取り組みを行っています。例えば、2021年7月、パレクセル社はCHCAMS(がん病院中国医学科学院)と協力し、中国における臨床試験のための患者中心のプロトコル方法論とデザインを設計しました。この協力により、がん患者の臨床試験経験を高めるための定量的研究が改善されました。この戦略により、同社は市場での存在感を高めています。
臨床試験市場企業
臨床試験業界で事業を展開する主な企業は以下の通り:
Charles River Laboratories
Clinipace
Eli Lilly and Company
ICON
IQVIA
Laboratory Corporation of America Holdings (Covance Inc)
Medpace
Merck & Co
Parexel International Corporation
Pfizer
SGS SA
Syneos Health
The Emmes Company
Thermo Fisher Scientific (PPD)
Veeda Clinical Research
Worldwide Clinical Trials
WuXi AppTech
IQVIAは、AIを活用したアナリティクス、リアルワールドエビデンス、分散型トライアルソリューションを駆使し、高度な臨床試験サービスを提供する世界有数の医薬品開発業務受託機関(CRO)です。2021年10月、IQVIAはQ2ソリューションズ子会社のために16万平方フィートのラボセンターを設立しました。この新センターは、最先端のバイオ分析、ゲノミクス、ワクチン、バイオマーカーのラボで構成される革新的なラボ能力スイートを提供し、バイオマーカー開発・提供のための複数のラボ分野を同一施設内で行うソリューションを業界に提供します。この戦略は、同社の市場プレゼンス全体を向上させることを目的としています。
ラボコープは、医薬品開発、中央検査室検査、患者募集を含む包括的な臨床試験サービスを提供しています。2021年12月、ラボコープは非臨床試験サービスを提供するCRO、トキシコン・コーポレーションを買収。トキシコンの買収は、同社の強固な非臨床開発ポートフォリオを向上させ、バイオテクノロジーや製薬企業の顧客と協力するための戦略的足がかりを作るのに役立ちます。
臨床試験業界のニュース
2024年2月、ICON plcは患者中心の臨床研究のための精密測定を専門とするクラウドベースのテクノロジー企業、HumanFirstを買収しました。HumanFirst の最先端技術を統合することで、アイコンはより高い精度と信頼性で患者の転帰を測定する能力を強化し、臨床試験の精度と効率を高めます。この買収は、高品質でデータ主導型のソリューションを提供し、最終的には顧客により効果的で個別化された研究結果をもたらすというアイコンの献身的な姿勢に沿ったものです。
2024年1月、パレクセルと日本がん研究振興財団(JFCR)は、日本におけるがん臨床試験へのアクセスを加速するための戦略的提携を発表しました。
2023年2月、ラボコープは臨床開発事業をスピンオフし、従業員数19,000人を超える独立系上場グローバルCROであり、医薬品および医療機器の総合的な開発サービスを提供するフォートレア社を設立することを発表しました。このスピンオフに伴い、ラボコープは事業を再編し、残りの医薬品開発部門をバイオファーマ・ラボラトリーサービス部門と改称しました。
2021年9月、シネオス・ヘルスは、テクノロジーを活用したリテンション型臨床試験リクルートのリーディングカンパニーであるStudyKIKを買収しました。この買収により、サイネオス・ヘルスはインサイトを活用したソリューションを提供する能力を強化し、臨床試験の募集、多様性、リテンションを強化しました。
2021年7月、ICON plcはPRA Health Sciencesの買収を完了しました。統合後の社名はアイコンとなり、47カ国に38,000人以上の従業員を擁すると報告されています。この統合は、患者、顧客、従業員、株主に対してより高い価値を提供するために、両社の優れた才能を活用した運営能力の強化に役立ちました。
2021年4月、クリニピースとdMed Globalは合併を宣言しました。この合併は、同社の地理的プレゼンスを世界的に拡大することに焦点を当てたものです。
この調査レポートは、臨床試験市場を詳細に調査し、2021年から2034年にかけての収益予測(百万米ドル)を掲載しています:
フェーズ別市場
フェーズI
フェーズII
フェーズIII
フェーズIV
試験デザイン別市場
介入研究
観察研究
拡張アクセス試験
市場:治療領域別
自己免疫疾患
腫瘍学
循環器
感染症
皮膚科学
眼科
神経学
血液内科
その他の治療分野
市場, サービス種類別
アウトソーシングサービス
自社サービス
上記の情報は、以下の地域および国について提供されています:
北米
アメリカ
カナダ
ヨーロッパ
ドイツ
英国
フランス
スペイン
イタリア
ポーランド
オランダ
スイス
アジア太平洋
中国
日本
インド
オーストラリア
韓国
シンガポール
マレーシア
インドネシア
タイ
フィリピン
中南米
ブラジル
メキシコ
アルゼンチン
中東・アフリカ
サウジアラビア
南アフリカ
アラブ首長国連邦
第1章 方法論と範囲
1.1 市場範囲と定義
1.2 調査デザイン
1.2.1 調査アプローチ
1.2.2 データ収集方法
1.3 ベースとなる推定と計算
1.3.1 基準年の算出
1.3.2 市場推計の主要トレンド
1.4 予測モデル
1.5 一次調査と検証
1.5.1 一次情報源
1.5.2 データマイニングソース
第2章 エグゼクティブサマリー
2.1 産業3600の概要
第3章 業界インサイト
3.1 業界エコシステム分析
3.2 業界の影響力
3.2.1 成長ドライバー
3.2.1.1 世界的な慢性疾患の有病率の増加
3.2.1.2 CROへの臨床試験アウトソーシング需要の高まり
3.2.1.3 政府および非政府による臨床試験資金の増加
3.2.1.4 アジア太平洋諸国における臨床試験実施の機会の増加
3.2.2 業界の落とし穴と課題
3.2.2.1 臨床研究の熟練労働者の不足
3.2.2.2 発展途上国におけるインフラの障壁
3.2.2.3 北米およびヨーロッパにおける臨床試験実施の課題
3.3 成長可能性分析
3.4 臨床試験数の分析
3.4.1 臨床試験件数分析(地域別、2021年~2024年
3.4.2 開発フェーズ別臨床試験件数分析(2021年~2024年
3.4.3 臨床試験件数分析、疾患別、2021年~2024年
3.5 薬事規制
3.5.1 アメリカ
3.5.2 ヨーロッパ
3.5.3 アジア太平洋
3.5.3.1 シンガポール
3.5.3.2 マレーシア
3.5.3.3 インドネシア
3.5.3.4 タイ
3.5.3.5 韓国
3.5.3.6 フィリピン
3.6 臨床試験 – アジア太平洋地域の優位性
3.7 ポーターズ分析
3.8 PESTEL分析
第4章 競争環境(2024年
4.1 はじめに
4.2 企業マトリックス分析
4.3 合併・買収の状況
4.4 主要市場プレーヤーの競合分析
4.5 競合のポジショニングマトリックス
4.6 戦略ダッシュボード
第5章 2021〜2034年フェーズ別市場推定・予測(単位:百万ドル)
5.1 主要動向
5.2 フェーズI
5.3 フェーズII
5.4 フェーズIII
5.5 フェーズIV
第6章 2021〜2034年試験デザイン別市場推定・予測($ Mn)
6.1 主要トレンド
6.2 インターベンション研究
6.3 観察研究
6.4 拡張アクセス試験
第7章 2021〜2034年 サービス種類別市場予測・予測 ($ Mn)
7.1 主要動向
7.2 アウトソーシングサービス
7.3 インハウスサービス
第8章 2021年~2034年治療領域別市場予測・予測 ($ Mn)
8.1 主要動向
8.2 自己免疫疾患
8.3 腫瘍学
8.4 循環器
8.5 感染症
8.6 皮膚科学
8.7 眼科
8.8 神経内科
8.9 血液内科
8.10 その他の治療分野
第9章 2021〜2034年地域別市場推定・予測(単位:Mnドル)
9.1 主要動向
9.2 北米
9.2.1 アメリカ
9.2.2 カナダ
9.3 ヨーロッパ
9.3.1 ドイツ
9.3.2 イギリス
9.3.3 フランス
9.3.4 スペイン
9.3.5 イタリア
9.3.6 ポーランド
9.3.7 オランダ
9.3.8 スイス
9.4 アジア太平洋
9.4.1 中国
9.4.2 日本
9.4.3 インド
9.4.4 オーストラリア
9.4.5 韓国
9.4.6 シンガポール
9.4.7 マレーシア
9.4.8 インドネシア
9.4.9 タイ
9.4.10 フィリピン
9.5 中南米
9.5.1 ブラジル
9.5.2 メキシコ
9.5.3 アルゼンチン
9.6 中東・アフリカ
9.6.1 サウジアラビア
9.6.2 南アフリカ
9.6.3 アラブ首長国連邦
第10章 企業プロフィール
10.1 Charles River Laboratories
10.2 Clinipace
10.3 Eli Lilly and Company
10.4 ICON
10.5 IQVIA
10.6 Laboratory Corporation of America Holdings (Covance Inc)
10.7 Medpace
10.8 Merck & Co
10.9 Parexel International Corporation
10.10 Pfizer
10.11 SGS SA
10.12 Syneos Health
10.13 The Emmes Company
10.14 Thermo Fisher Scientific (PPD)
10.15 Veeda Clinical Research
10.16 Worldwide Clinical Trials
10.17 WuXi AppTech
*** 本調査レポートに関するお問い合わせ ***
