世界の前臨床医療機器試験サービス市場:サービス種類別(生体内試験、体外試験、ベンチ・機械試験)、機器分類別(植込み型機器、非植込み型機器、体外診断用医療機器)、外部委託モデル別、動物モデル種類別、用途別、エンドユーザー別 – 世界市場予測 2025-2032年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
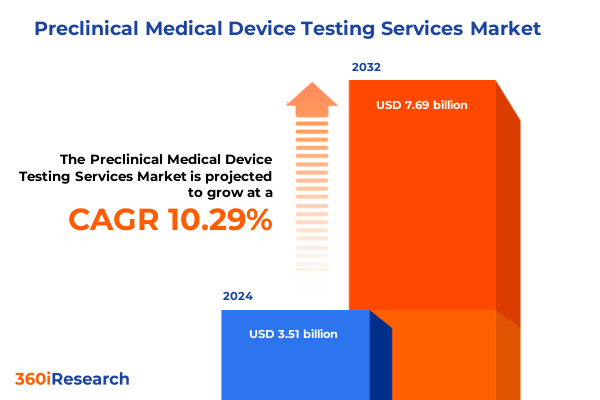
前臨床医療機器試験サービス市場は、2024年に35.1億米ドルと推定され、2025年には38.6億米ドルに達し、2032年までに年平均成長率(CAGR)10.29%で76.9億米ドルに成長すると予測されています。この市場は、規制の厳格化、技術の進歩、そしてステークホルダーの期待が複雑に絡み合う領域へと進化しており、医療機器の概念段階から臨床応用への成功的な移行を支える上で、安全性、有効性、性能評価が不可欠です。近年、規制当局による監視の強化は、標準化された試験プロトコルの重要性を高めています。同時に、画像診断、in vitroプラットフォーム、動物モデルにおける進歩は、研究者や製造業者に利用可能な分析ツールキットを拡大しました。特に、新規の生体適合性アッセイ、高解像度画像診断モダリティ、高度な機械的ストレスシミュレーションの導入は、デバイス開発の基礎段階を変革しています。これらの進歩は、デバイス製造業者、医薬品開発業務受託機関(CRO)、学術研究機関間の連携強化によって補完されており、革新を促進しつつ、進化する基準への厳格な順守を求める環境を創出しています。技術革新と規制遵守の相互作用を探ることは、市場の決定的な変化と戦略的考慮事項に関する広範な議論の基礎を築きます。
前臨床医療機器試験サービスの進化を推進する主要な要因は多岐にわたります。第一に、デジタル技術と人工知能(AI)の統合が挙げられます。画像診断やデータ分析へのAI導入は、安全シグナルやデバイス性能特性の特定を効率化しています。機械学習アルゴリズムの進歩により、CT、MRI、超音波などの大量の画像データセットのリアルタイム解釈が可能になり、予測精度が向上し、開発期間が短縮されています。第二に、in vitroモデルの進化です。組織工学プラットフォームや複雑な細胞アッセイなどのin vitroモデルは、動物実験への依存度を低減させるとともに、デバイスの生体適合性に関してより人間に関連性の高い洞察を提供しています。これと並行して、倫理的および規制上の圧力は、動物モデルの利用に対するより繊細なアプローチを推進しており、改良と削減の戦略が重視されています。第三に、連携ネットワークの強化です。医薬品開発業務受託機関(CRO)、大学、OEM(相手先ブランド製造業者)間の協力関係は、プロトコルの標準化をさらに加速させ、生体適合性、機械的疲労、機能試験におけるベストプラクティスが普遍的に採用されることを保証しています。第四に、規制の厳格化と倫理的要件です。規制当局による監視の強化は、試験プロトコルの標準化と透明性を求め、デバイスの安全性と有効性の厳格な評価を不可欠なものにしています。最後に、米国の2025年関税政策の影響も、市場の適応と戦略的再編を促す要因となっています。特定の試験装置や主要製造拠点から調達される原材料に対する関税は、コスト構造を上昇させ、サプライヤー契約の見直しや代替調達戦略の検討を余儀なくさせています。これにより、CROや医療機器製造業者は、ベンダーポートフォリオの多様化、現地製造能力への投資、国内機器生産者との戦略的パートナーシップの模索を進めており、強靭なサプライチェーン構築の必要性が強調されています。これらの適応は、市場の柔軟性と革新を促進する側面も持ちます。
前臨床医療機器試験サービス市場は、その多様な側面を理解するために、いくつかの重要なセグメントに分類されます。サービスタイプ別では、生体内試験(In Vivo Testing)、in vitro試験(In Vitro Testing)、ベンチ&機械試験(Bench & Mechanical Testing)に大別されます。生体適合性アッセイ(細胞毒性、刺激性、感作性)から、CT、MRI、超音波などの高度な画像診断サービス、細胞アッセイプラットフォームや組織工学構造を用いたin vitro試験、そしてマウスやラットなどのげっ歯類モデル、犬、豚、霊長類、ウサギなどの大型非げっ歯類モデルを用いた生体内評価まで、幅広い試験技術が提供されています。圧縮試験、引張試験、厳格な疲労プロトコルなどの機械試験は、シミュレートされた生理学的条件下でのデバイスの耐久性に関する重要な洞察を提供します。デバイスカテゴリ別では、心臓弁やステントなどの心血管インプラント、インプラントや歯科矯正システムを含む歯科デバイス、神経モニタリングおよび神経刺激プラットフォーム、眼内レンズやレーザー治療を含む眼科ソリューション、そしてインプラント型ハードウェアと義肢デバイスの両方を含む整形外科構造など、専門的な要件を持つデバイスが対象となります。エンドユーザー別では、学術研究機関、大学、フルサービスおよびニッチな医薬品開発業務受託機関(CRO)、研究重視および教育病院、グローバルOEM、中小医療機器製造業者、大手製薬企業、革新的なバイオテクノロジー企業など、多様な顧客のニーズが反映されています。アプリケーション別では、機能試験、性能試験、安全性試験に焦点を当てています。これには、電気的および機械的機能評価、疲労性能および摩耗評価、細胞毒性、血液適合性、毒性試験が含まれます。これらのセグメンテーションは、多岐にわたるこの分野におけるサービス需要の推進要因を包括的に把握するための全体的な視点を提供します。
地域ごとの動向は、前臨床医療機器試験サービスの優先順位と投資パターンに大きな影響を与えます。アメリカ大陸では、高度な研究インフラと医療機器製造業者とCRO間の強力な連携が、画像診断サービス、機械的検証研究、生体内モデリングへの堅固な重点を推進しています。研究重視の病院や主要な学術機関の存在が、次世代のin vitroプラットフォームや改良された生体適合性プロトコルの採用を加速させています。欧州、中東、アフリカ(EMEA)地域では、厳格な規制枠組みと多様な研究能力が、調和された試験基準と動物利用に関する倫理的考慮が最重要視される状況を形成しています。主要な欧州の研究拠点における産学連携によって、組織工学や細胞アッセイへの投資が増加しています。同時に、中東およびアフリカにおける能力構築イニシアチブは、地域に特化したCROサービスの成長を促進し、共同試験プログラムの新たな道を開いています。アジア太平洋地域は、急速なインフラ開発、政府支援の臨床研究インセンティブ、そして大小動物モデルにおける専門知識の台頭が特徴です。地域の大学、新興バイオテクノロジー企業、CRO間の革新的なパートナーシップは、特に整形外科および心血管デバイス製造量の多い市場において、性能および安全性試験の統合を加速させています。この地域特性のモザイクは、地域の規制、倫理、技術エコシステムに合わせたオーダーメイドのサービス提供の重要性を強調しています。
前臨床医療機器試験サービス市場の主要プロバイダーは、技術的差別化、包括的なサービスポートフォリオ、および協調的なイノベーションモデルによって特徴づけられます。主要なCROは、専門的な画像診断施設やin vitroラボの戦略的買収を通じて提供サービスを拡大し、生体適合性評価から複雑な機械的疲労試験まで、エンドツーエンドのソリューションを可能にしています。同時に、機器製造業者はモジュール式試験プラットフォームとAI駆動型分析に投資し、ハードウェア、ソフトウェア、データインテリジェンスのシームレスな統合を通じてその価値提案を差別化しています。学術研究機関内に組み込まれたイノベーションハブは、デバイス開発者と連携し、予測精度と倫理的遵守を向上させる次世代アッセイプラットフォームや改良された動物モデルを共同で開発するケースが増えています。さらに、グローバルOEMとブティック試験ラボ間の提携は、心血管および神経デバイス評価、高度な眼科レンズ相互作用など、カスタマイズされたプロトコルの開発を促進しています。これらの協調モデルは、運用能力だけでなく、分野横断的な知識交換と規制専門知識においても優位に立つ競争上の必要性を強調しています。業界リーダーは、関税による混乱を軽減するために、サプライヤーネットワークを多様化し、国内機器製造業者との戦略的パートナーシップを構築することで、サプライチェーンの回復力を強化することを優先すべきです。AI駆動型画像分析やクラウドベースのデータ管理を含むデジタル変革戦略への投資は、研究期間の短縮と前臨床評価の再現性向上に不可欠となるでしょう。さらに、組織は、高度なin vitroプラットフォームなどの代替試験方法を統合し、進化するガイドラインに沿って動物モデルプロトコルを改良することにより、倫理的および規制上のベストプラクティスを推進する必要があります。学術、臨床、産業界のステークホルダー間での協力を積極的に育成することは、新規アッセイプラットフォームや専門知識へのアクセスを可能にし、運用効率と科学的厳密性の両方を高めます。最終的に、セグメンテーションおよび地域分析からの実用的な洞察をサービス開発ロードマップに組み込むことで、試験提供がデバイス固有および地理的要件に合致し続け、関連性と競争優位性を最大化することが保証されます。
以下に、ご指定の「前臨床医療機器試験サービス」を正確に使用し、詳細な階層構造で目次を日本語に翻訳します。
—
**目次**
1. **序文**
* 市場セグメンテーションとカバレッジ
* 調査対象期間
* 通貨
* 言語
* ステークホルダー
2. **調査方法論**
3. **エグゼクティブサマリー**
4. **市場概要**
5. **市場インサイト**
* 前臨床心血管デバイス評価における臓器チッププラットフォームの採用
* インプラント試験における動物使用削減のための高度なコンピューターシミュレーションへの依存度向上
* 神経変調デバイスの前臨床評価のための専門GLP認定ラボの成長
* 心臓デバイス性能の生体内モニタリングにおけるリアルタイムテレメトリーの進歩
* 整形外科デバイス試験の生体力学データ分析における機械学習アルゴリズムの使用
* 国際規制機関間での生体適合性試験プロトコルの標準化への取り組み
* 動物モデルにおける肺ステント構造評価を強化するためのマイクロCTイメージングの登場
* 現実的なカテーテルデバイス検証のための患者固有の3Dプリント血管ファントムの統合
* インプラントの安全性プロファイルを評価するためのナノ材料コーティングデバイス生体適合性アッセイの開発
6. **2025年の米国関税の累積的影響**
7. **2025年の人工知能の累積的影響**
8. **前臨床医療機器試験サービス市場:サービスタイプ別**
* 生体内試験 (In Vivo Testing)
* 生体適合性および毒性研究 (Biocompatibility & Toxicology Studies)
* インプラント性能と耐久性 (Implant Performance & Durability)
* 薬物動態学と生体内分布 (Pharmacokinetics & Biodistribution)
* 安全性および忍容性研究 (Safety & Tolerability Studies)
* 生体外試験 (In Vitro Testing)
* 細胞ベースアッセイ (Cell-Based Assays)
* 血液適合性試験 (Hemocompatibility Testing)
* 遺伝毒性および細胞毒性試験 (Genotoxicity & Cytotoxicity Testing)
* ベンチおよび機械試験 (Bench & Mechanical Testing)
* 性能および機能試験 (Performance & Functional Testing)
* 物理的および環境ストレス試験 (Physical & Environmental Stress Testing)
* 微生物学および滅菌サービス (Microbiology & Sterility Services)
* 滅菌保証とバリデーション (Sterility Assurance & Validation)
* 微生物限度およびバイオバーデン試験 (Microbial Limits & Bioburden Testing)
* 抗菌有効性試験 (Antimicrobial Efficacy Testing)
* 包装および貯蔵寿命サービス (Packaging & Shelf-Life Services)
* 包装完全性試験 (Package Integrity Testing)
* 輸送および流通シミュレーション (Transportation & Distribution Simulation)
* 促進およびリアルタイム老化研究 (Accelerated & Real-Time Aging Studies)
* ソフトウェアおよびデジタルヘルス試験 (Software & Digital Health Testing)
* 組み込みソフトウェア検証 (Embedded Software Verification)
* サイバーセキュリティおよび接続性試験 (Cybersecurity & Connectivity Testing)
* ヒューマンファクターおよびユーザビリティエンジニアリング (Human Factors & Usability Engineering)
* 化学特性評価サービス (Chemical Characterization Services)
* 抽出物および溶出物研究 (Extractables & Leachables Studies)
* 材料特性評価 (Material Characterization)
* 残留物および汚染物質分析 (Residuals & Contaminants Analysis)
9. **前臨床医療機器試験サービス市場:デバイスカテゴリ別**
* 埋め込み型デバイス (Implantable Devices)
* 心血管インプラント (Cardiovascular Implants)
* 整形外科インプラント (Orthopedic Implants)
* 歯科インプラント (Dental Implants)
* 眼科インプラント (Ophthalmic Implants)
* 神経変調インプラント (Neuromodulation Implants)
* 非埋め込み型デバイス (Non Implantable Devices)
* 手術器具 (Surgical Instruments)
* 創傷ケアデバイス (Wound Care Devices)
* 診断およびモニタリング機器 (Diagnostic & Monitoring Equipment)
* ウェアラブル医療機器 (Wearable Medical Devices)
* 使い捨て医療機器 (Single Use Disposables)
* 体外診断用デバイス (In Vitro Diagnostic Devices)
* 試薬キットおよびアッセイ (Reagent Kits & Assays)
* 機器および分析装置 (Instruments & Analyzers)
* ポイントオブケアIVDデバイス (Point Of Care IVD Devices)
10. **前臨床医療機器試験サービス市場:アウトソーシングモデル別**
* フルサービスアウトソーシング (Full-Service Outsourcing)
* 機能別アウトソーシング (Functional Outsourcing)
* プロジェクトベースの契約 (Project-Based Engagements)
* 長期戦略的パートナーシップ (Long-Term Strategic Partnerships)
* インソーシングサポート (Insourcing Support)
11. **前臨床医療機器試験サービス市場:動物モデルタイプ別**
* げっ歯類 (Rodents)
* ウサギ (Rabbits)
* イヌ (Canines)
* ブタ (Swine)
* 非ヒト霊長類 (Non-Human Primates)
12. **前臨床医療機器試験サービス市場:用途別**
* デバイス安全性評価 (Device Safety Assessment)
* 有効性および性能研究 (Efficacy & Performance Studies)
* プロトタイプ検証 (Prototype Validation)
* 規制当局提出支援 (FDA/HC) (Regulatory Submission Support (FDA/HC))
13. **前臨床医療機器試験サービス市場:エンドユーザー別**
* 医療機器メーカー (Medical Device Manufacturers)
* 開発製造受託機関 (Contract Development & Manufacturing Organizations)
* 学術・研究機関 (Academic & Research Institutions)
* 大学および教育病院 (Universities & Teaching Hospitals)
* 独立研究機関 (Independent Research Institutes)
* 政府および非営利団体 (Government & Nonprofit Organizations)
* 公衆衛生機関 (Public Health Agencies)
* 標準化および規制機関 (Standards & Regulatory Bodies)
* 投資家および戦略的パートナー (Investors & Strategic Partners)
* ベンチャーキャピタルおよびプライベートエクイティ (Venture Capital & Private Equity)
* 戦略的企業投資家 (Strategic Corporate Investors)
14. **前臨床医療機器試験サービス市場:地域別**
* 米州 (Americas)
* 北米 (North America)
* ラテンアメリカ (Latin America)
* 欧州、中東、アフリカ (Europe, Middle East & Africa)
* 欧州 (Europe)
* 中東 (Middle East)
* アフリカ (Africa)
* アジア太平洋 (Asia-Pacific)
15. **前臨床医療機器試験サービス市場:グループ別**
* ASEAN
* GCC
* 欧州連合 (European Union)
* BRICS
* G7
* NATO
16. **前臨床医療機器試験サービス市場:国別**
* 米国 (United States)
* カナダ (Canada)
* メキシコ (Mexico)
* ブラジル (Brazil)
* 英国 (United Kingdom)
* ドイツ (Germany)
* フランス (France)
* ロシア (Russia)
* イタリア (Italy)
* スペイン (Spain)
* 中国 (China)
* インド (India)
* 日本 (Japan)
* オーストラリア (Australia)
* 韓国 (South Korea)
17. **競争環境**
* 市場シェア分析、2024年 (Market Share Analysis, 2024)
* FPNVポジショニングマトリックス、2024年 (FPNV Positioning Matrix, 2024)
* 競合分析 (Competitive Analysis)
* Eurofins Scientific SE
* Charles River Laboratories International, Inc.
* Bureau Veritas S.A.
* AGINKO Research AG
* Canyon Labs
* CERTANIA Holding GmbH
* Gradient, Inc.
* ICON plc
* Inotiv, Inc.
* Intertek Group plc
* IQVIA
18. **図目次 [合計: 32]**
19. **表目次 [合計: 1593]**
………… (以下省略)
*** 本調査レポートに関するお問い合わせ ***

医療機器開発の初期段階で、その安全性と有効性を科学的に評価する「前臨床医療機器試験サービス」は、患者の健康と安全を確保し、革新的な医療技術を社会に届ける上で不可欠です。このサービスは、新しい医療機器が人体に適用される前に、性能、安全性、生体適合性などを厳格に検証し、薬事承認取得の重要な基盤となります。
前臨床試験の最大の目的は、医療機器が意図された用途で患者に危害を加えず、期待される効果を発揮することを科学的に証明することです。材料の毒性、物理的・化学的安定性、滅菌プロセスの有効性、生体組織との相互作用などを多角的に評価します。これにより、潜在的なリスクを早期に特定し、設計段階での改善を促すことで、開発後期の手戻りや市場投入後の問題発生を防ぎます。これは開発コスト削減だけでなく、患者の安全確保という倫理的側面からも極めて重要です。
試験は多岐にわたりますが、主要なのは「生体適合性試験」です。これは、医療機器が人体に接触する際に、細胞毒性、感作性、刺激性、全身毒性、遺伝毒性、発がん性、埋植後の局所反応、溶血性など、有害反応を引き起こさないことをISO 10993シリーズ等の国際規格に基づき確認します。次に、「物理的・化学的特性評価」では、材料の組成、強度、耐久性、腐食耐性、滅菌適合性などを分析し、機器の基本要件を検証します。さらに、「機能性評価」では、機器が設計通りに動作し、期待される性能を発揮するかをベンチテストやシミュレーションで確認します。特定の医療機器では、生体内の挙動、長期安全性、薬物相互作用を評価するため「動物試験」も実施されますが、倫理的配慮から3R原則(Replacement, Reduction, Refinement)に基づき厳しく審査されます。
これらの試験は、日本の医薬品医療機器等法(PMDA)、米国食品医薬品局(FDA)、欧州のCEマークなど、各国の規制当局が定める厳格な要件を満たす必要があります。そのため、試験機関はGLP(優良試験所規範)等の品質管理システムを確立し、試験の信頼性、再現性、データの一貫性を保証します。専門サービスを利用することで、メーカーは高額な設備投資や人材育成なしに、複雑な規制要件に効率的かつ確実に準拠できます。また、経験豊富な第三者機関による客観的評価は、薬事承認申請の信頼性を高め、開発プロセスの迅速化に寄与します。
近年、医療機器はAI、ソフトウェア、複合製品など複雑性を増し、前臨床試験も高度で専門的なアプローチが求められています。サイバーセキュリティ評価、ソフトウェア単体医療機器(SaMD)の検証、コンビネーション製品の評価など、新たな課題が浮上しています。動物実験代替法の開発やリアルワールドデータ(RWD)を活用した評価手法の導入など、試験の効率化と倫理性の向上に向けた取り組みも活発化しています。グローバル市場展開を視野に入れるメーカーにとって、国際的な規制調和の動向を把握し、対応できる試験サービスパートナーの存在は、ますます重要性を増しています。
前臨床医療機器試験サービスは、単なる技術検証に留まらず、医療の進歩を支え、患者のQOL向上に貢献する重要なゲートキーパーです。このサービスを通じて、安全性と有効性が十分に確認された医療機器のみが市場に供給され、医療現場の信頼維持と社会全体の公衆衛生水準向上に繋がるのです。