世界のマイクロキャリア市場:タイプ別(合成マイクロキャリア、天然マイクロキャリア)、培養方式別(バッチ培養、流加培養、灌流培養)、機器タイプ別、用途別、エンドユーザー別、流通チャネル別 – 世界市場予測 2025-2032年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
## マイクロキャリア市場の現状、推進要因、および展望に関する詳細レポート要約
### 市場概要
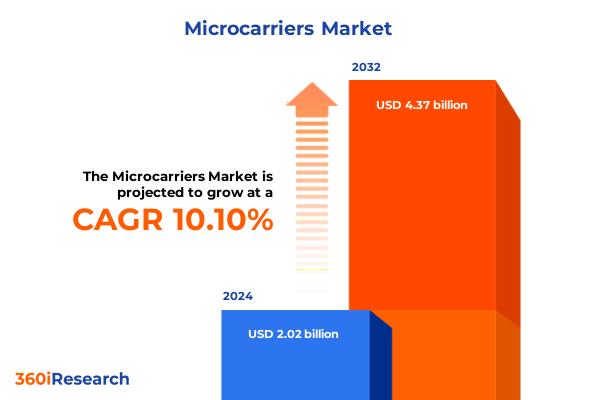
2024年において、**マイクロキャリア**市場は20.2億米ドルと推定され、2025年には22.2億米ドルに達し、2032年までには年平均成長率(CAGR)10.10%で43.7億米ドルに成長すると予測されています。**マイクロキャリア**は、現代のバイオプロセシングにおいて極めて重要な技術として浮上しており、接着依存性細胞を工業規模で培養するという長年の課題に対する実用的な解決策を提供します。これらの微小粒子は、攪拌槽型バイオリアクターなどの形式において高い表面積対体積比を提供することで、接着細胞を従来の平面培養ではなく三次元懸濁培養で増殖させることを可能にします。この能力は、ワクチン、組換えタンパク質、および間葉系幹細胞製品から誘導多能性幹細胞(iPSC)由来製品に至るまで、幅広い細胞ベース療法の生産規模拡大に不可欠です。
バイオ医薬品産業がより複雑なモダリティへと移行するにつれて、より高い体積生産性だけでなく、高度に制御され、再現性があり、規制に準拠した製造プラットフォームへの需要が高まっています。**マイクロキャリア**ベースのシステムは、スケーラブルなエンジニアリングとプロセス分析技術、そして細胞の表現型、効力、製品品質の維持に役立つ高度な培地処方を組み合わせることで、このニーズに応えます。間葉系幹細胞などの接着性細胞株の臨床グレードでの拡大に関する証拠は、慎重に設計された**マイクロキャリア**プロセスが厳格なc GMP要件を満たしつつ、全身投与に必要な大量の細胞を提供できることを示しています。
同時に、**マイクロキャリア**は、シングルユースバイオリアクターの台頭、灌流培養などの集約培養への移行、ゼノフリーおよび血清低減培地への転換、そして製造ライフサイクル全体における自動化とデジタル制御の統合といった複数のマクロトレンドの交差点に位置しています。したがって、サプライヤーとエンドユーザーは、製品選択だけでなく、プラットフォームの標準化、施設設計、および労働力の能力に関するより広範な問題にも対処する必要があります。本レポートは、技術、政策、および地域開発がバリューチェーン全体のステークホルダーにとっての機会とリスクをどのように再形成しているかを多角的な視点から捉え、**マイクロキャリア**の現状、変化の様相、そして今後の投資および運用戦略への影響について、簡潔かつ詳細な理解を提供することを目的としています。
### 推進要因
**1. 変革をもたらす技術とプロセスの変化:**
**マイクロキャリア**分野は、バイオリアクター工学、細胞生物学、およびデジタルプロセス制御における進歩の収束によって、大きな変革期を迎えています。歴史的に、多くの施設は平面培養システムや単純な攪拌フラスコに依存しており、達成可能な細胞密度が制限され、労働集約度が高まっていました。現代の実践は、pH、溶存酸素、代謝物、その他の重要パラメーターの堅牢なモニタリングを伴う高密度三次元培養を可能にする、完全に統合された**マイクロキャリア**ベースのバイオリアクターへと決定的に移行しています。この進化は、間葉系幹細胞の大規模拡大において特に顕著であり、最適化された**マイクロキャリア**の選択と制御された攪拌が、臨床的に関連する規模で分化能力と免疫調節特性を維持することが示されています。
ハードウェアのこの変化と並行して、プロセス哲学も変化しています。バッチ培養と流加培養は依然として広く使用されていますが、連続的または準連続的な生産をサポートするように設計された灌流ベースの戦略と共存することが増えています。灌流操作は、培地を継続的に交換し、廃棄物を除去することで、長期間にわたって高細胞密度を維持し、多くの場合、シングルユースまたはハイブリッドバイオリアクター形式で行われます。このアプローチは、培養環境を安定させ、体積生産性を向上させ、周期的な向流クロマトグラフィーなどの下流プロセスと連携することで、エンドツーエンドの連続製造をサポートします。これらの利点は、不安定な生物製剤、ウイルスベクター、および滞留時間と環境変動が品質特性に大きく影響するその他の製品にとって特に魅力的です。
材料科学も**マイクロキャリア**のポートフォリオを再形成しています。ポリスチレンなどの従来の合成基材は、その機械的堅牢性と十分に理解された規制プロファイルにより、ワクチンおよび組換えタンパク質生産において依然として定着しています。同時に、特に細胞療法および組織工学において、ゼラチン、アルギン酸、セルロース誘導体、およびその他の天然ポリマーに基づく、より生体適合性があり生分解性の高いキャリアへの強い勢いがあります。穏やかな酵素的または物理的な細胞回収を可能にする分解性**マイクロキャリア**は、下流の回収を簡素化し、せん断応力を低減し、生存率や機能を損なうことなく全体的な収量を高めることができるため、注目を集めています。
もう一つの重要な変革は、自動化、リアルタイム分析、およびますます洗練された制御アルゴリズムの統合です。高度な施設では、バッチ間の変動性を軽減し、供給および攪拌プロファイルを最適化し、予測的な逸脱管理を可能にするために、モデルベースおよびデータ駆動型の制御戦略を**マイクロキャリア**プロセスに重ね合わせています。機械論的モデルと人工知能または強化学習を組み合わせたハイブリッドアプローチが細胞療法製造に提案されており、**マイクロキャリア**培養が静的なレシピではなく自己最適化するデジタルツインによって管理される未来を示唆しています。
最後に、規制および品質に関する期待がプロセス設計を方向付けています。北米、ヨーロッパ、およびその他の地域の機関は、高度な治療製品の重要プロセスパラメーター(CPP)と重要品質特性(CQA)の徹底的な特性評価を強調しています。これにより、ゼノフリー培地、血清代替戦略、および**マイクロキャリア**原材料のより完全に文書化されたサプライチェーンの採用が促進されています。これらの変革的な変化は、**マイクロキャリア**プラットフォームの最先端を再定義しています。それは単にビーズとバイオリアクターだけでなく、次世代の生物製剤の要求に合わせた材料、ハードウェア、ソフトウェア、および品質システムの緊密に連携したエコシステムを意味します。
**2. 地域的視点:**
地域的なダイナミクスは、**マイクロキャリア**技術がどのように採用され、標準化され、規模が拡大されるかに強い影響を与えます。
* **アメリカ大陸:** 特に米国では、**マイクロキャリア**ベースのシステムは、高度な生物製剤および細胞ベース療法に焦点を当てたバイオ医薬品企業、受託製造業者、および研究機関の密集した集中から恩恵を受けています。再生医療指定などの革新的な治療法の迅速な審査をサポートする規制経路は、スケーラブルで高品質な製造プラットフォームへの投資を促進しています。これにより、モノクローナル抗体、ワクチン、および急速に拡大する細胞・遺伝子療法ポートフォリオにおける**マイクロキャリア**アプリケーションをサポートするために、シングルユースおよびハイブリッドバイオリアクター、高度な自動化、およびデータ豊富なプロセスモニタリングが早期かつ広範に展開されています。
* **ヨーロッパ、中東、アフリカ(EMEA):** 状況はより多様ですが、同様に重要です。主要なヨーロッパのバイオテクノロジー集積地は、細胞・遺伝子療法において深い専門知識を維持しており、強力な産学連携と、高度治療医薬品(ATMP)に対する厳格かつイノベーションを意識した規制枠組みを備えています。しかし、国境を越えた複雑で時には断片的な規制プロセスが、米国や中国と比較して臨床試験活動を遅らせている場合があり、さらなる調和が求められています。この状況において、**マイクロキャリア**の展開は、コンプライアンス、データインテグリティ、および原材料のトレーサビリティとクローズドシステム処理に関する進化するガイダンスとの整合性を重視することがよくあります。中東およびアフリカの一部地域における生物製剤および細胞療法インフラへの新たな投資は、最初からシングルユースおよび**マイクロキャリア**技術を採用するグリーンフィールド施設を中心に、新たな需要の結節点を生み出しています。
* **アジア太平洋:** 生物製剤製造およびワクチン生産の中心地として急速に発展しており、この変化は**マイクロキャリア**の使用に直接的な影響を与えます。中国、インド、韓国、日本などの国々は、大規模なバイオリアクター能力に多額の投資を行っており、多くの場合、**マイクロキャリア**ベースの接着細胞培養に適したシングルユースシステムを備えたモジュール式施設を好んでいます。この地域がワクチンおよびバイオシミラーの主要生産国としての役割を果たしていることと、細胞・遺伝子療法研究の急増が相まって、臨床および商業プログラム全体で合成および天然の両方の**マイクロキャリア**の採用が加速しています。同時に、この地域の政府は、バイオ医薬品供給における自給自足の強化を目的とした政策を推進しており、樹脂、培地、**マイクロキャリア**などの主要な投入物の現地生産を奨励しています。
これらの地域パターンは、**マイクロキャリア**がどこで調達され使用されるかだけでなく、どこで設計され製造されるかにも影響を与えます。サプライヤーは、製品ロードマップを主要な地域アプリケーションのニーズに合わせて調整することが増えています。例えば、アジア太平洋地域の高スループットワクチンライン、北米の複雑な細胞療法、ヨーロッパの厳格に規制された高度治療などです。関税、輸出規制、および現地調達政策が進化し続けるにつれて、地域戦略はさらに差別化される可能性が高く、地理的ポートフォリオのバランスはサプライヤーとエンドユーザーの両方にとって重要な考慮事項となるでしょう。
**3. セグメンテーションのダイナミクス:**
**マイクロキャリア**の主要なセグメンテーション次元を解釈すると、用途によって需要パターンと技術選好がどのように異なっているかが明らかになります。
* **タイプ別:** ポリスチレンやその他のエンジニアードポリマーなどの合成**マイクロキャリア**は、機械的安定性、一貫した表面化学、および深い規制上の前例を提供するため、多くの確立されたワクチンおよび組換えタンパク質プロセスを支え続けています。並行して、ゼラチン、アルギン酸、セルロース、および同様の生体高分子に由来する天然**マイクロキャリア**は、生体適合性、分解性、および穏やかな細胞回収が最優先される細胞療法および組織工学において、より大きな重要性を獲得しています。しかし、これら2つのファミリー間の対比は、合成材料の堅牢性と天然基材の生物学的利点の両方を提供することを目指すハイブリッドおよび表面改質システムによって、ますます二元的ではなくなっています。
* **培養プロセス別:** 培養モードに関するプロセスセグメンテーションも、**マイクロキャリア**の採用をさらに形成します。バッチ培養は、その簡潔さと技術移転の容易さから、研究および初期開発段階で依然として主力として活用されています。流加培養プロセスは、時間をかけて培地を導入して培養期間を延長し、力価を高めるもので、多くの商業用生物製剤施設で支配的であり、接着依存性細胞株の**マイクロキャリア**ベースの拡大と容易に互換性があります。灌流培養は、細胞を保持しながら培地を継続的に交換し、廃棄物を除去することで、より安定した製品品質プロファイルとより高い体積生産性を伴う集約製造を追求する組織の間で注目を集めています。灌流用に最適化された**マイクロキャリア**システムは、ビーズのサイズ、密度、および表面特性と、流体力学および細胞保持戦略とのバランスを取る必要があり、キャリア設計とバイオリアクター工学の密接な統合が重視されます。
* **機器タイプ別:** 機器関連のセグメンテーションは、消耗品と耐久資産の相互依存性を強調しています。消耗品側では、**マイクロキャリア**は、特定の細胞タイプ、血清使用哲学、および規制要件に合わせて調整された専用培地および試薬と組み合わせて使用されます。ゼノフリーおよび血清低減処方は、特に臨床および商業的な細胞療法において急速に拡大しており、選択されたキャリア上での効率的な接着と増殖をサポートしながら細胞の効力を維持する培地への需要を促進しています。機器側では、バイオリアクター、培養容器、細胞計数器、ろ過システム、および関連アクセサリーが、**マイクロキャリア**プロセスを大規模に運用可能にするハードウェアの基盤を形成します。攪拌槽型および垂直ホイール型バイオリアクターは、**マイクロキャリア**上での大規模な接着細胞拡大に頻繁に展開され、細胞計数およびイメージング技術は、細胞密度、生存率、および凝集挙動に関する重要なフィードバックを提供します。
* **アプリケーションエリア別:** アプリケーションのセグメンテーションは、明確な成熟度曲線と性能基準を明らかにします。バイオ医薬品製造では、**マイクロキャリア**は組換えタンパク質およびワクチン生産をサポートし、堅牢性、バッチ間の一貫性、および既存の規制申請との互換性が技術選択において重視されます。対照的に、細胞療法では、免疫調節や細胞毒性などの繊細な機能的特性を維持することに重点が置かれ、せん断保護、穏やかな回収、および最小限の操作が中心的な考慮事項となります。研究開発ユーザーは、柔軟性と費用対効果を重視し、前臨床データを生成するためにさまざまな細胞タイプで合成および天然の両方のキャリアを試すことがよくあります。組織工学アプリケーションは、**マイクロキャリア**を拡大プラットフォームとしてだけでなく、埋め込み可能または構造物に結合可能な三次元足場としても活用し、製造補助具と治療成分との境界を曖昧にしています。
* **エンドユーザー別:** エンドユーザーのセグメンテーションは、さまざまな購買要因を浮き彫りにします。学術機関および研究機関は、適応性、科学的サポート、および多様な実験室インフラとの互換性を優先し、多くの場合、複数の**マイクロキャリア**形式で少量を調達します。受託研究機関(CRO)は、スポンサーと製造パートナー間の効率的な技術移転を促進するプラットフォームを求め、標準化と明確な文書化に高い価値を置きます。製薬およびバイオテクノロジー企業は、**マイクロキャリア**、培地、および機器を複数のプログラムで検証された統合プラットフォームに結び付ける統合ソリューションを好む傾向があり、規制上の変動性を低減し、スケールアップを合理化することを目指しています。
* **流通チャネル別:** 最後に、流通チャネルのセグメンテーションは、進化する調達行動を反映しています。直接販売および販売代理店ネットワークを含むオフラインチャネルは、技術コンサルティング、オンサイトサポート、および検証サービスが不可欠な場合に依然として重要です。灌流バイオリアクター、自動化レイヤー、およびカスタマイズされた**マイクロキャリア**処方を含む複雑な設置には、通常、サプライヤーと顧客間の長期にわたる販売サイクルにわたる緊密な協力が必要です。しかし、オンラインチャネルは、特に研究グレードの**マイクロキャリア**、培地、および小型機器において拡大しており、デジタルカタログとeコマースプラットフォームが価格比較、注文、および補充を簡素化しています。オフラインとオンラインの経路間の相互作用は、サプライヤーが商業組織をどのように構築し、バイヤーが在庫、承認、およびベンダー認定をどのように管理するかを再形成しています。
**4. 競争環境:**
**マイクロキャリア**および関連するバイオプロセス技術を取り巻く競争環境は、多角的なライフサイエンスコングロマリット、専門のバイオプロセス企業、および特定の材料やアプリケーションに焦点を当てたニッチなイノベーターが混在しています。細胞培養培地、シングルユースバイオリアクター、および下流ハードウェアの広範なポートフォリオを持つ大規模なプラットフォームサプライヤーは、**マイクロキャリア**を統合ソリューションの一部として位置付けています。彼らの戦略は、ベンチから商業規模までの一貫したプラットフォーム、強力な規制サポート、およびグローバルな技術サービスネットワークを強調しており、これらはすべて、後期製造移行のリスクを軽減しようとする製薬およびバイオテクノロジー企業に響きます。
これらの広範な製品を提供する企業と並んで、いくつかの企業は、特定の細胞タイプに合わせて調整された**マイクロキャリア**の設計、表面化学、または天然材料の処方に特化しています。これらの企業は、間葉系幹細胞、多能性幹細胞、または初代細胞の接着と増殖を促進する独自のコーティング、または細胞回収と埋め込みを簡素化する分解性マトリックスによって差別化を図ることがよくあります。学術グループや初期段階の治療法開発者とのコラボレーションが一般的であり、新たな生物学的洞察や臨床ニーズに対応して**マイクロキャリア**の特性を迅速に反復することができます。
バイオリアクターおよび自動化の専門家も重要な役割を果たしています。攪拌槽型、垂直ホイール型、ロッキング型、およびその他のバイオリアクター形式を提供するベンダーは、特に灌流または集約流加条件下での**マイクロキャリア**ベースのプロセスにおいて、優れた性能を実証するために競争しています。多くは、リアルタイムモニタリングと多変量制御が可能な高度なセンサー、プロセス分析技術(PAT)、およびソフトウェアスイートを統合しており、規制に準拠したデータ管理によって支えられています。これらの機能は、高度な治療法の申請のために重要プロセスパラメーターと品質特性を詳細に文書化する必要がある顧客にとって、ますます決定的なものとなっています。
受託開発製造機関(CDMO)や専門のプロセス開発コンサルタントなどのサービス指向企業は、競争環境をさらに形成しています。好ましい**マイクロキャリア**とバイオリアクターの組み合わせを中心に構築されたプラットフォームプロセスを開発することで、複数のスポンサーや適応症にわたってどの技術が普及するかを左右します。スケールアップ、技術移転、および規制当局の検査に関する彼らの実践的な経験は、製品設計にフィードバックされ、サプライヤーに流体力学的ストレスに対する堅牢性、回収の容易さ、またはクローズドシステム操作との互換性などの属性を改善するよう促します。
全体として、競争分野は製品中心の差別化からエコシステム中心の差別化へと移行しています。**マイクロキャリア**、培地、バイオリアクター、分析、およびサービスを、一貫性のあるデータ豊富なプラットフォームにシームレスに接続できる組織は、特にエンドユーザーが開発期間を短縮し、製品ライフサイクルの後半での費用のかかるプロセス変更のリスクを最小限に抑えようとするにつれて、戦略的優位性を獲得しています。
### 展望と課題
**1. 2025年米国関税および輸出規制の累積的影響:**
2025年の米国関税政策は、グローバルサプライチェーンを通じて**マイクロキャリア**、培養培地、および関連するバイオプロセス機器を調達する組織にとって、新たな複雑さをもたらしました。政権がほとんどの輸入品に10%の基本関税を課す決定を下したことにより、特定の近隣諸国に対する例外と追加の国別追加料金を除き、バイオ製造に関連する多くのコンポーネントを含む幅広い産業投入品の輸入コストの下限が実質的に引き上げられました。**マイクロキャリア**自体が関税スケジュールで明示的に対象とされていない場合でも、これらの措置の影響を受ける同じ樹脂、ポリマー、およびステンレス鋼のサプライチェーンと密接に関連しています。
一般的な基本関税を超えて、セクター固有の関税措置はより直接的な影響を与えています。米国通商代表部(USTR)は、中国およびその他の管轄区域からの医療およびバイオテクノロジー関連の輸入に対する大幅なセクション301関税引き上げを最終決定しました。これには、2024年および2025年に発効する使い捨てマスク、ゴム製医療用手袋、および特定の注射器と針に対する急激な引き上げが含まれます。これらのカテゴリーは、バイオリアクター、チューブ、フィルター、および**マイクロキャリア**と並行して使用される滅菌消耗品を供給する広範なシングルユースエコシステムと重複しています。同時に、中国からの輸入に対する広範な関税と中国からの報復措置は、断続的なエスカレーションと部分的な撤回という環境を生み出し、企業はコスト構造と納期における継続的な不確実性を管理することを余儀なくされました。
関税措置を補完するものとして、米国商務省からの新たな輸出規制は、特定の高度なフローサイトメーターや質量分析プラットフォームなど、高パラメーターの生物学的データを生成できる高度なバイオテクノロジー機器のライセンス要件を厳格化しました。これらの機器は**マイクロキャリア**そのものではありませんが、**マイクロキャリア**上で拡大された細胞集団を特性評価し、高度な治療法製造の品質管理をサポートする上で重要な役割を果たします。このような機器の出荷または設置場所に関する制限は、一部の企業に開発ラボ、製造スイート、および受託試験パートナーシップの地理的分布を再考するよう促しています。
これらの措置の累積的な影響は、いくつかの側面で現れています。コストの可視性が悪化し、調達チームは定価だけでなく、変動する関税、潜在的な免除、およびさらなる政策変更のリスクも考慮に入れる必要があります。一部の製造業者は、着地コストを安定させ、輸出規制への露出を減らすために、**マイクロキャリア**、培地、およびシングルユースアセンブリの生産を米国またはより有利な貿易関係を持つ国に現地化する計画を加速させています。他の企業は、突然の関税の急増や規制上の混乱に備えて、異なる管轄区域で二次または三次供給源を追加することで、サプライヤーベースを多様化しています。
戦略的に、2025年の関税環境は、**マイクロキャリア**プラットフォームおよび関連機器を評価する際に、ステークホルダーをより包括的な総所有コスト(TCO)評価へと押し進めています。合成**マイクロキャリア**と天然**マイクロキャリア**、再利用可能なバイオリアクターとシングルユースバイオリアクター、および自動化の程度に関する決定は、技術的性能と品質結果だけでなく、さまざまな貿易および規制シナリオ下での回復力によってもますます情報提供されるようになっています。最も効果的に対応する組織は、関税と輸出規制を一時的な異常ではなく、ネットワーク設計における構造的要因として扱い、シナリオプランニングと供給リスク分析を資本および調達の決定に組み込んでいる組織です。
**2. 業界リーダーへの推奨事項:**
進化する**マイクロキャリア**の状況を行動に移すには、技術的野心と運用的実用主義のバランスを取る慎重なアプローチが必要です。業界リーダーにとって最も影響力のあるステップの1つは、異なる製品クラスに対して、**マイクロキャリア**のタイプ、培養モード、培地、およびバイオリアクター構成の好ましい組み合わせを定義するプラットフォーム戦略を正式化することです。このようなプラットフォームを確立し、複数のプログラムで検証することで、特注のプロセス開発の必要性を大幅に減らし、初期臨床段階から商業製造への移行時の規制上の正当化を簡素化できます。
同時に、組織は、科学的および政策的軌道が流動的である場合に柔軟性を組み込むことで、これらのプラットフォームを将来にわたって対応できるようにする必要があります。例えば、プロセス設計は、血清含有培地からゼノフリー培地への、または流加培養から灌流への段階的な移行を、さまざまな条件下で堅牢に機能する**マイクロキャリア**と機器を選択することで予測できます。関税の変動、輸出規制、および潜在的な現地調達要件を明示的に考慮したシナリオプランニングは、新しい製造能力をどこに配置するか、重要な**マイクロキャリア**と培地の二重調達をどのように構築するか、および代替サプライヤーをいつ認定するかに関する決定を導くことができます。
労働力開発ももう一つの重要な焦点分野です。**マイクロキャリア**システムがより自動化され、データ集約的になるにつれて、細胞生物学、工学、データサイエンス、および品質システムにわたる横断的な専門知識の必要性が高まっています。ターゲットを絞ったトレーニング、社内の実践コミュニティ、および学術または技術パートナーとの共同プロジェクトへの投資は、**マイクロキャリア**ベースのバイオプロセシングにおけるベストプラクティスの組織全体への普及を加速させることができます。この人的資本の視点は、平面培養や単純なスピナーシステムから完全に統合された連続操作へと移行する施設にとって特に重要です。
最後に、リーダーはパートナーシップを戦術的な調達選択ではなく、戦略的なレバーとして捉えるべきです。特定の治療モダリティに合わせて調整された**マイクロキャリア**またはバイオリアクター構成の共同開発に関してサプライヤーと早期に関与することで、長期的なパイプラインとより密接に連携したプラットフォームを生み出すことができます。受託製造業者や専門のプロセス開発組織とのコラボレーションも、スケールアップと技術移転のリスクを軽減することができます。**マイクロキャリア**を交換可能なコモディティとしてではなく、差別化された製造戦略の中心的な要素として捉えることで、企業はスピード、品質、およびコストにおいて永続的な優位性を獲得する立場に立つことができます。
この詳細な分析は、**マイクロキャリア**市場が、技術革新、規制環境の変化、地政学的要因、および進化するエンドユーザーのニーズによって、ダイナミックに変革を遂げていることを明確に示しています。
以下に、ご指定のTOCを日本語に翻訳し、詳細な階層構造で示します。
—
**目次**
1. **序文**
* 市場セグメンテーションと対象範囲
* 調査対象年
* 通貨
* 言語
* ステークホルダー
2. **調査方法**
3. **エグゼクティブサマリー**
4. **市場概要**
5. **市場インサイト**
* 高度な表面機能化技術が幹細胞の接着と増殖率を向上させる
* 革新的な生分解性マイクロキャリアが持続可能な細胞療法製造プロセスを強化する
* ナノエンジニアリングされたマイクロキャリアの新たなトレンドが細胞微小環境の精密な制御を可能にする
* マイクロキャリアベースのバイオリアクターの統合がウイルスベクター生産のための浮遊細胞培養を効率化する
* 使い捨てマイクロキャリアの採用がバイオ医薬品における無菌大規模細胞増殖を加速させる
* カスタマイズ可能なマイクロキャリア製剤がc GMP哺乳類細胞培養における規制順守を満たす
* デジタルモニタリングおよび自動化ツールがマイクロキャリアバイオプロセスパラメータをリアルタイムで最適化する
* 戦略的パートナーシップがマイクロキャリア技術プロバイダーのグローバルサプライチェーン拡大を推進する
* キセノフリーおよび化学的に定義されたマイクロキャリア製剤への移行
* 穏やかな細胞回収のための溶解性マイクロキャリアの採用増加
* 細胞療法のための閉鎖系自動バイオリアクターとの統合
6. **2025年米国関税の累積的影響**
7. **2025年人工知能の累積的影響**
8. **マイクロキャリア市場:タイプ別**
* 合成マイクロキャリア
* 天然マイクロキャリア
9. **マイクロキャリア市場:培養プロセス別**
* バッチ培養
* 補給培養
* 灌流培養
10. **マイクロキャリア市場:機器タイプ別**
* 消耗品
* 培地
* 試薬
* 機器
* アクセサリー
* バイオリアクター
* 細胞計数器
* 培養容器
* ろ過システム
11. **マイクロキャリア市場:用途別**
* バイオ医薬品生産
* モノクローナル抗体生産
* 組換えタンパク質生産
* ワクチン製造
* 細胞・遺伝子治療
* ウイルスベクター生産
* 治療用細胞増殖
* 再生医療・組織工学
* 基礎研究・スクリーニング
* 細胞生物学研究
* ハイスループットスクリーニング
12. **マイクロキャリア市場:エンドユーザー別**
* 学術・研究機関
* 受託研究機関
* 製薬・バイオテクノロジー企業
* 病院・臨床検査機関
13. **マイクロキャリア市場:流通チャネル別**
* オフライン
* 直接販売
* 販売代理店ネットワーク
* オンライン
14. **マイクロキャリア市場:地域別**
* 米州
* 北米
* 中南米
* 欧州、中東、アフリカ
* 欧州
* 中東
* アフリカ
* アジア太平洋
15. **マイクロキャリア市場:グループ別**
* ASEAN
* GCC (湾岸協力会議)
* 欧州連合
* BRICS
* G7
* NATO
16. **マイクロキャリア市場:国別**
* 米国
* カナダ
* メキシコ
* ブラジル
* 英国
* ドイツ
* フランス
* ロシア
* イタリア
* スペイン
* 中国
* インド
* 日本
* オーストラリア
* 韓国
17. **競合情勢**
* 市場シェア分析、2024年
* FPNVポジショニングマトリックス、2024年
* 競合分析
* Danaher Corporation
* Thermo Fisher Scientific Inc.
* Corning Incorporated
* FUJIFILM Holdings Corporation
* Sartorius AG
………… (以下省略)
*** 本調査レポートに関するお問い合わせ ***

マイクロキャリアは、接着依存性細胞の大量培養を可能にする革新的な技術として、バイオテクノロジーおよびバイオ医薬品生産分野において極めて重要な役割を担っています。これらは通常、直径数十から数百マイクロメートルの微小な粒子であり、細胞がその表面に接着して増殖するための足場を提供します。従来の静置培養では、培養容器の表面積が細胞増殖の律速段階となるため、大規模な細胞培養には限界がありましたが、マイクロキャリアの導入により、単位体積あたりの細胞密度を飛躍的に向上させることが可能となりました。この技術は、ワクチン、モノクローナル抗体、組換えタンパク質、さらには細胞治療用の細胞など、多岐にわたるバイオ医薬品の効率的な生産に不可欠な基盤を提供しています。
マイクロキャリアの素材は多岐にわたり、デキストラン、ポリスチレン、ガラス、ゼラチン、セルロースなどが一般的に用いられます。これらの素材は、細胞の種類や培養目的によって選択され、表面は細胞接着を促進するためにコラーゲン、フィブロネクチン、ポリ-L-リシン、または細胞外マトリックス成分などで修飾されることが一般的です。また、マイクロキャリアには、細胞が表面にのみ接着する非多孔質タイプと、内部の空隙にも細胞が侵入して増殖できる多孔質タイプがあり、後者はより高い細胞密度を実現できる可能性があります。これらの多様な選択肢が、特定の細胞株や培養条件に最適なマイクロキャリアを見つけることを可能にしています。
マイクロキャリア培養の最大の利点は、その高い表面積対体積比にあります。これにより、比較的小型のバイオリアクター内で、フラスコ培養の数百倍から数千倍もの細胞を培養することが可能となり、生産コストの削減と生産効率の向上に大きく寄与します。また、攪拌型バイオリアクターでの懸濁培養が可能となるため、栄養供給やガス交換が効率的に行われ、培養環境の均一性が保たれやすくなります。さらに、培養スケールの拡大が容易である点も大きなメリットであり、研究室レベルから工業生産レベルへの移行をスムーズにします。細胞の回収や培養液からの分離も、マイクロキャリアの特性を利用することで効率的に行える場合が多く、下流工程の簡素化にも貢献します。
しかし、マイクロキャリア培養にはいくつかの課題も存在します。攪拌型バイオリアクターにおける細胞へのせん断応力は、マイクロキャリア培養における主要な課題の一つであり、細胞の損傷や剥離を引き起こす可能性があります。これを最小限に抑えるためには、適切な攪拌速度の選択、リアクター設計の最適化、または細胞保護剤の使用が求められます。また、マイクロキャリアと細胞の分離、特に細胞治療など、マイクロキャリアが最終製品に混入してはならない用途においては、効率的かつ細胞にダメージを与えない分離技術の開発が不可欠です。さらに、マイクロキャリア自体のコストや、特定の細胞株に合わせた培養条件の最適化には、時間と専門知識が必要となります。
近年では、より生体適合性の高い素材の開発、細胞接着・増殖を促進する表面修飾技術の進化、そして3次元培養や灌流培養システムとの統合が進んでいます。特に、幹細胞やiPS細胞などの再生医療分野における応用が注目されており、これらの細胞の大量培養と分化誘導を効率的に行うための新たなマイクロキャリア技術が研究されています。また、細胞の増殖だけでなく、特定の機能発現や組織形成を促進するような、より高度な機能を持つマイクロキャリアの開発も進められています。これらの技術革新により、マイクロキャリアは今後もバイオ医薬品生産の効率化と高度化に一層貢献し、生命科学研究および医療の発展に不可欠なツールとしての地位を確立していくことでしょう。