世界の非小細胞肺癌治療薬市場:治療法別(化学療法、免疫療法、標的療法)、治療ライン別(一次治療、二次治療、三次以降)、バイオマーカー発現別、流通チャネル別 – グローバル市場予測 2025年~2032年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
**非小細胞肺癌治療薬市場の現状、推進要因、および今後の展望**
**市場概要**
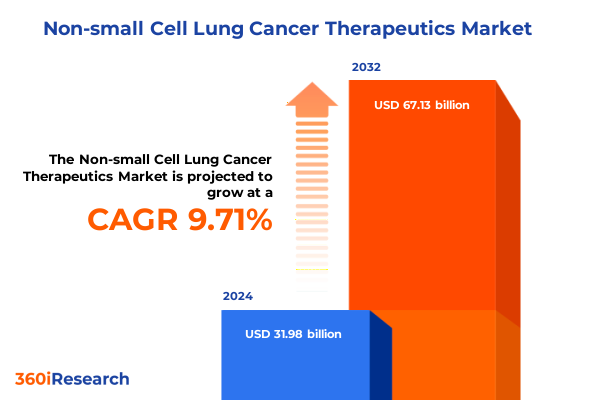
非小細胞肺癌治療薬市場は、2024年に319.8億米ドル、2025年には349.8億米ドルと推定され、2032年までに年平均成長率(CAGR)9.71%で671.3億米ドルに達すると予測されています。この市場は、非小細胞肺癌(NSCLC)における治療法の革新と、依然として存在するアンメットニーズへの対応という強い要請によって推進されています。NSCLCは肺癌の大部分を占め、その分子レベルでの多様性と進行性の臨床経過は、これまで持続的な治療成果を妨げてきました。治療パラダイムが非特異的な細胞傷害性レジメンから精密医療へと移行する中で、革新的な介入の緊急性がますます顕著になっています。学術界、産業界、医療提供システムにわたるステークホルダーは、科学的ブレークスルーを患者の具体的な利益へと迅速に転換するための協力体制を構築しており、この複雑な背景の中で、新たな薬剤や併用療法の登場は、これまで漸進的な進歩に留まっていた分野に新たな楽観論をもたらしています。
**市場を牽引する主要因**
1. **治療法の革新と個別化医療の進展:**
非小細胞肺癌治療薬の分野は、免疫調節と標的アプローチにおける画期的な進歩によって根本的に変化しました。PD-1およびPD-L1阻害剤、CTLA-4阻害剤などの免疫療法は、単剤療法だけでなく、化学療法や抗血管新生化合物との併用により相乗効果を示し、有効性と忍容性を最適化する新たな併用療法の時代を切り開いています。また、EGFR、ALK、ROS1、BRAFなどの遺伝子異常を標的とする精密腫瘍学は、分子サブセットの固有の脆弱性を利用し、個別化された治療を可能にしています。診断技術も進化しており、次世代シーケンシング(NGS)やリキッドバイオプシープラットフォームは、作用可能な変異の迅速かつ低侵襲な検出と、動的な治療モニタリングを可能にしています。これらのイノベーションは患者層別化を洗練させ、薬剤検証を加速する適応的試験デザインにも貢献しています。さらに、データ統合ソリューションや人工知能(AI)ツールは、治療抵抗性や有害事象プロファイルに関する予測モデリングを強化し、個別化されたケアパスウェイへの移行を加速させています。規制当局によるアンメットニーズの高い適応症に対する迅速承認経路の制定も、市場成長の肥沃な土壌となっています。
2. **サプライチェーンとコスト構造の再構築:**
2025年の米国における関税政策の変更、特に輸入原薬(API)に対するセクション301関税は、非小細胞肺癌治療薬のサプライチェーンとコスト構造に大きな影響を与えています。これにより、原材料のリードタイムが長期化し、供給の継続性が課題となっています。これに対応し、バイオ医薬品企業は国内API生産と戦略的備蓄への投資を加速させ、外部政策変動への露出を軽減し、国家のバイオ製造能力強化に貢献しています。民間ステークホルダーと政府機関との協力コンソーシアムも、生産能力の拡大と高度な製剤技術におけるイノベーションを支援しており、コスト圧力が強まる中で、パイプラインの活力を維持し、患者アクセスを確保するための戦略的な再調整が進んでいます。
3. **治療タイプ、治療ライン、バイオマーカー発現、流通チャネルの多様な動向:**
市場のセグメンテーション分析は、治療薬の利用と開発の優先順位における明確なダイナミクスを示しています。治療タイプ別では、化学療法が後期治療で基礎的な役割を維持する一方で、免疫療法(PD-1/PD-L1/CTLA-4阻害剤)が第一選択および第二選択レジメンの要として台頭しています。標的療法は、ALK、ROS1、BRAF変異、次世代EGFR阻害剤など、発癌性ドライバーを標的として補完的な役割を果たしています。治療ライン別では、第一選択レジメンが免疫腫瘍学と標的薬剤の併用を増加させている一方、第二選択および第三選択では多様な単剤療法と併用療法が混在しています。バイオマーカー発現による層別化は、コンパニオン診断の重要性を強調し、EGFR変異型やALK再配列型、高PD-L1発現者に対する分子的に適合した薬剤の優位性を示しています。流通チャネルでは、複雑な点滴療法における病院薬局ネットワークが依然として優位ですが、経口標的薬や免疫調節薬の調剤においてはオンラインおよび小売薬局の役割が増大しています。
4. **地域別の成長とアクセス格差:**
非小細胞肺癌治療薬の地域差は、疫学的パターンと医療インフラの多様性を反映しています。米州では、堅調なパイプライン、合理化された規制、広範な臨床試験ネットワーク、標準化されたNGS、価値に基づく償還制度が、精密な治療マッチングと新規薬剤の採用を促進しています。欧州、中東、アフリカ(EMEA)地域では、多様な医療技術評価プロセスとインフラ整備のばらつきにより採用が不均一ですが、新興市場では地域パートナーシップが能力拡大を促進しています。アジア太平洋地域では、バイオ製造の現地化と臨床試験参加の強化を目指す政府主導の積極的なイニシアチブが急速な成長を牽引しており、日本や韓国では画期的な治療法に対する高度な償還モデルが、中国では進化する規制改革がグローバルスポンサーを引き付けています。
5. **主要企業の戦略的ポジショニングと競争:**
主要な製薬およびバイオテクノロジー企業は、差別化された免疫腫瘍学資産と次世代標的療法を中心に非小細胞肺癌治療薬のポートフォリオを構築しています。メルクのペムブロリズマブ、ブリストル・マイヤーズ スクイブのニボルマブとイピリムマブ、アストラゼネカのデュルバルマブなどが市場を牽引しています。ロシュは買収を通じて標的療法ラインナップを拡大し、分子標的アプローチの重要性を強調しています。新興バイオテクノロジー企業は、ファーストインクラスの二機能性抗体や新規共有結合阻害剤などでニッチ市場を開拓しています。大手製薬会社と専門バイオテクノロジー企業との提携が拡大し、臨床開発、バイオマーカー特定、商業的規模拡大における中核的コンピテンシーを組み合わせています。また、連続生産やデジタル化された品質管理システムを含む製造イノベーションを標的とする戦略的提携も進んでおり、運用上の卓越性への再編成を示唆しています。
**今後の展望と戦略的提言**
非小細胞肺癌治療薬市場のステークホルダーは、今後の成長を最大化し、開発経路を加速するために、いくつかの戦略的提言を実行する必要があります。第一に、包括的なバイオマーカー検査を日常的な臨床ワークフローに統合し、患者選択を最適化し、治験登録効率を高めることが不可欠です。次に、治療反応と耐性に関する予測モデルを開発するために、臨床、診断、データ分析のステークホルダーを結びつける分野横断的なパートナーシップを構築すべきです。サプライチェーンのリスクを軽減するためには、調達源を多様化し、国内製造能力への投資を優先することが求められます。さらに、長期的な安全性と有効性データを収集するためにリアルワールドエビデンスプログラムを拡大し、支払者との交渉における価値提案を強化する必要があります。最後に、デジタルヘルスソリューションを患者管理経路に組み込むことで、服薬遵守の改善、有害事象の遠隔監視、個別化されたサポート提供が可能となります。これらの的を絞った措置を実行することで、ステークホルダーはパイプラインの活力を維持し、市場投入までの時間を短縮し、命を救う非小細胞肺癌治療薬への持続可能なアクセスを強化できるでしょう。
以下に、ご指定の「Basic TOC」と「Segmentation Details」を組み合わせて構築した、詳細な階層構造の日本語目次を提示します。
—
**目次**
* **序文**
* 市場セグメンテーションと対象範囲
* 調査対象年
* 通貨
* 言語
* ステークホルダー
* **調査方法**
* **エグゼクティブサマリー**
* **市場概要**
* **市場インサイト**
* 非小細胞肺癌におけるEGFRおよびMET耐性経路を標的とする二重特異性抗体療法の出現
* 非小細胞肺癌の早期発見と治療モニタリングにおける循環腫瘍DNAアッセイの採用拡大
* 非小細胞肺癌の治療選択と転帰を個別化するためのAI駆動型画像診断の統合
* 以前は難治性であった非小細胞肺癌サブタイプにおいて有効性を示す新規KRAS G12C阻害剤の開発
* 非小細胞肺癌患者の耐性変異を克服するための次世代ALK阻害剤への投資増加
* 早期非小細胞肺癌における術後チェックポイント阻害剤を評価する術後補助免疫療法試験の拡大
* 遺伝子プロファイルを超えた標的非小細胞肺癌治療のためのNTRK融合を活用する組織非特異的療法の台頭
* 肺腫瘍特異性を向上させ、毒性を低減するナノ粒子ベースの薬物送達システムの進歩
* ファーストライン非小細胞肺癌における化学療法とのPD-1/PD-L1併用療法の承認と市場導入動向
* 非小細胞肺癌の病理学的奏効率を高めるための術前免疫化学療法プロトコルの使用急増
* **2025年の米国関税の累積的影響**
* **2025年の人工知能の累積的影響**
* **非小細胞肺癌治療薬市場:治療タイプ別**
* 化学療法
* 免疫療法
* CTLA-4阻害剤
* イピリムマブ
* PD-1阻害剤
* ニボルマブ
* ペムブロリズマブ
* PD-L1阻害剤
* アテゾリズマブ
* アベルマブ
* ドゥルバルマブ
* 分子標的療法
* ALK阻害剤
* BRAF阻害剤
* EGFR阻害剤
* 第1世代
* 第2世代
* 第3世代
* ROS1阻害剤
* **非小細胞肺癌治療薬市場:治療ライン別**
* ファーストライン
* 化学療法
* 併用療法
* 免疫療法
* 分子標的療法
* セカンドライン
* 化学療法
* 併用療法
* 免疫療法
* 分子標的療法
* サードライン以降
* 化学療法
* 併用療法
* 免疫療法
* 分子標的療法
* **非小細胞肺癌治療薬市場:バイオマーカー発現別**
* ALK再構成
* EGFR変異
* 高PD-L1発現
* KRAS変異
* **非小細胞肺癌治療薬市場:流通チャネル別**
* 病院薬局
* オンライン薬局
* 小売薬局
* **非小細胞肺癌治療薬市場:地域別**
* 米州
* 北米
* 中南米
* 欧州、中東、アフリカ
* 欧州
* 中東
* アフリカ
* アジア太平洋
* **非小細胞肺癌治療薬市場:グループ別**
* ASEAN
* GCC
* 欧州連合
* BRICS
* G7
* NATO
* **非小細胞肺癌治療薬市場:国別**
* 米国
* カナダ
* メキシコ
* ブラジル
* 英国
* ドイツ
* フランス
* ロシア
* イタリア
* スペイン
* 中国
* インド
* 日本
* オーストラリア
* 韓国
* **競合情勢**
* 市場シェア分析、2024年
* FPNVポジショニングマトリックス、2024年
* 競合分析
* アムジェン株式会社
* アストラゼネカPLC
* バイオジェン株式会社
* ブリストル・マイヤーズ スクイブ社
* F. ホフマン・ラ・ロシュ社
* メルク・アンド・カンパニー・インク
* ノバルティスAG
* ファイザー株式会社
* リジェネロン・ファーマシューティカルズ・インク
* 武田薬品工業株式会社
* バイエルAG
* グラクソ・スミスクラインplc
* **図目次 [合計: 28]**
* 世界の非小細胞肺癌治療薬市場規模、2018-2032年(百万米ドル)
* 世界の非小細胞肺癌治療薬市場規模:治療タイプ別、2024年対2032年(%)
* 世界の非小細胞肺癌治療薬市場規模:治療タイプ別、2024年対2025年対2032年(百万米ドル)
* 世界の非小細胞肺癌治療薬市場規模:治療ライン別、2024年対2032年(%)
* 世界の非小細胞肺癌治療薬市場規模:治療ライン別、2024年対2025年対2032年(百万米ドル)
* 世界の非小細胞肺癌治療薬市場規模:バイオマーカー発現別、2024年対2032年(%)
* 世界の非小細胞肺癌治療薬市場規模:バイオマーカー発現別、2024年対2025年対2032年(百万米ドル)
* 世界の非小細胞肺癌治療薬市場規模:流通チャネル別、2024年対2032年(%)
* 世界の非小細胞肺癌治療薬市場規模:流通チャネル別、2024年対2025年対2032年(百万米ドル)
* 世界の非小細胞肺癌治療薬市場規模:地域別、2024年対2025年対2032年(百万米ドル)
* 米州の非小細胞肺癌治療薬市場規模:サブ地域別、2024年対2025年対2032年(百万米ドル)
* 北米の非小細胞肺癌治療薬市場規模:国別、2024年対2025年対2032年(百万米ドル)
* 中南米の非小細胞肺癌治療薬市場規模:国別、2024年対2025年対2032年(百万米ドル)
* 欧州、中東、アフリカの非小細胞肺癌治療薬市場規模:サブ地域別、2024年対2025年対2032年(百万米ドル)
* 欧州の非小細胞肺癌治療薬市場規模:国別、2024年対2025年対2032年(百万米ドル)
* **表目次 [合計: 1065]**
………… (以下省略)
*** 本調査レポートに関するお問い合わせ ***

非小細胞肺癌(NSCLC)は、肺癌の大部分を占める疾患であり、その治療は長らく困難を伴ってきました。しかし、近年の医学の進歩は目覚ましく、特に治療薬の分野において画期的な発展を遂げ、患者の予後と生活の質を大きく改善しています。かつては細胞傷害性抗癌剤が治療の中心でしたが、現在では分子標的薬や免疫チェックポイント阻害薬といった革新的な薬剤が加わり、治療戦略は多様化し、個別化医療へと大きく舵を切っています。
従来の細胞傷害性抗癌剤は、急速に増殖する癌細胞を非選択的に攻撃することで効果を発揮します。これにより、癌細胞だけでなく正常な細胞にもダメージを与え、骨髄抑制、消化器症状、脱毛などの全身性の副作用を引き起こすことが避けられませんでした。これらの薬剤は、依然として特定の状況下で重要な役割を担いますが、より効果的で副作用の少ない治療法の開発が求められていました。
このニーズに応える形で登場したのが分子標的薬です。非小細胞肺癌の癌細胞には、特定の遺伝子変異やタンパク質の異常が認められることがあり、分子標的薬はこれらの異常な分子をピンポイントで狙い撃ちすることで、癌の増殖や生存に必要なシグナル伝達経路を阻害します。代表的な標的としては、上皮成長因子受容体(EGFR)遺伝子変異、未分化リンパ腫キナーゼ(ALK)融合遺伝子、ROS1融合遺伝子、BRAF遺伝子変異、MET遺伝子変異などが挙げられます。これらの遺伝子異常を持つ患者に対しては、それぞれに対応するチロシンキナーゼ阻害薬(TKI)が投与され、高い奏効率と良好な予後を示すことが報告されています。しかし、分子標的薬の課題は、治療開始後しばらくすると癌細胞が薬剤耐性を獲得し、効果が減弱してしまう点にあります。この耐性メカニズムを克服するため、新たな世代の分子標的薬や、異なる作用機序を持つ薬剤との併用療法が研究・開発されています。
さらに、近年NSCLC治療に革命をもたらしたのが免疫チェックポイント阻害薬です。癌細胞は、免疫細胞の攻撃から逃れるために、PD-1やCTLA-4といった免疫チェックポイント分子を利用して免疫応答を抑制します。免疫チェックポイント阻害薬は、これらの分子の働きをブロックすることで、T細胞が癌細胞を認識し攻撃する能力を回復させます。この治療法は、特定の遺伝子変異に依存しないため、より幅広い患者に適用可能であり、一部の患者では長期にわたる奏効が期待できるという画期的な特徴を持ちます。ペムブロリズマブやニボルマブなどが代表的な薬剤であり、PD-L1の発現状況や腫瘍の遺伝子変異量(TMB)などが治療効果を予測するバイオマーカーとして研究されています。しかし、免疫関連有害事象(irAE)と呼ばれる特有の副作用が発生する可能性があり、その管理には専門的な知識が求められます。
現在、非小細胞肺癌の治療戦略は、これらの薬剤を単独で用いるだけでなく、複数の薬剤を組み合わせる併用療法へと進化しています。例えば、化学療法と免疫チェックポイント阻害薬の併用、あるいは分子標的薬と免疫チェックポイント阻害薬の併用など、異なる作用機序を持つ薬剤を組み合わせることで、相乗効果や耐性克服を目指す試みが積極的に行われています。これにより、より多くの患者で治療効果の最大化と持続性の向上が期待されています。
非小細胞肺癌治療薬の未来は、さらなる個別化医療の推進にあります。次世代シーケンサーを用いた包括的な遺伝子解析により、これまで見過ごされてきた稀な遺伝子変異を標的とする薬剤の開発や、耐性メカニズムを克服する新たな治療戦略の確立が期待されます。また、治療効果をより正確に予測するバイオマーカーの探索や、免疫チェックポイント阻害薬の奏効を高めるための併用療法の開発も重要な研究課題です。これらの進歩は、非小細胞肺癌の治療成績をさらに向上させ、患者一人ひとりに最適な治療を提供する未来を切り拓くでしょう。