世界のバイオ医薬品受託試験サービス市場:サービスタイプ別(バイオアッセイ、微生物学的試験、物理化学的試験など)、技術別(クロマトグラフィー、ELISA、質量分析など)、用途別、エンドユーザー別、検体種別 – 世界市場予測 2025年~2032年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
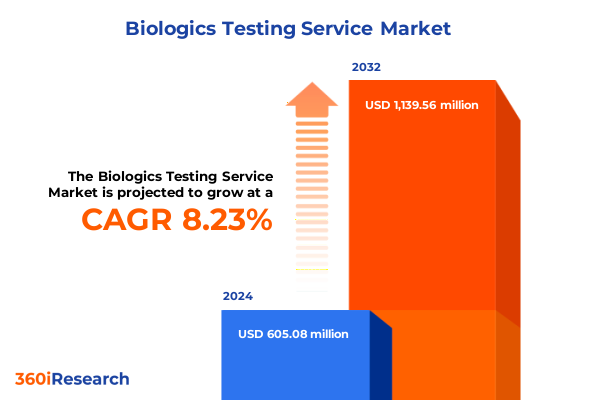
バイオ医薬品受託試験サービス市場は、2024年に6億508万米ドル、2025年に6億4518万米ドルと推定され、2032年までに年平均成長率(CAGR)8.23%で11億3956万米ドルに成長すると予測されています。この市場は、新規治療法の厳格な品質・安全基準達成を保証する基盤として、現代の医薬品開発に不可欠です。過去10年間でバイオ医薬品は製薬イノベーションの最前線に躍り出ており、複雑な分子の特性評価、汚染物質検出、治療効果検証のための高度な試験サービスが不可欠となっています。遺伝子治療、細胞治療、次世代モダリティを含むパイプラインの多様化に伴い、アジャイルでハイスループットな試験パートナーへの需要が増大。サービスプロバイダーは、規制要件、技術的ブレークスルー、経済的圧力といった多面的な状況を乗り越える必要があり、品質を損なわずスループットを向上させるため、自動化、デジタルレポート作成、高度な分析に投資しています。世界中の規制当局はバイオ医薬品特有の安全性の懸念に対処するためガイドラインを洗練させており、開発者と試験サービスパートナー間の協力がコンプライアンス確保に不可欠です。
以下に、ご指定の「Basic TOC」と「Segmentation Details」を統合し、詳細な階層構造で日本語に翻訳した目次を構築します。
—
**目次**
1. **序文**
* 市場セグメンテーションと対象範囲
* 調査対象年
* 通貨
* 言語
* ステークホルダー
2. **調査方法**
3. **エグゼクティブサマリー**
4. **市場概要**
5. **市場インサイト**
* 包括的なバイオ医薬品品質管理のためのハイスループット次世代シーケンシングの統合
* ウイルスベクター特性評価ワークフローを効率化するためのシングルユースバイオリアクタープラットフォームの拡大
* バイオ医薬品の安定性および不純物プロファイルの予測におけるAI駆動型分析の採用拡大
* モノクローナル抗体生産におけるPAT技術を用いたリアルタイムリリース試験の導入
* 世界市場におけるバイオシミラーの機能的同等性を評価するための迅速な細胞ベースアッセイの需要増加
6. **2025年米国関税の累積的影響**
7. **2025年人工知能の累積的影響**
8. **バイオ医薬品受託試験サービス市場:サービスタイプ別**
* バイオアッセイ
* 結合アッセイ
* 競合
* 間接
* サンドイッチ
* 細胞ベースアッセイ
* 力価アッセイ
* 微生物学的
* 生物負荷試験
* エンドトキシン試験
* 無菌性試験
* 物理化学的
* クロマトグラフィー
* ガスクロマトグラフィー
* 高速液体クロマトグラフィー
* 超高速液体クロマトグラフィー
* 分光法
* フーリエ変換赤外
* 核磁気共鳴
* 紫外可視
* 熱分析
* 示差走査熱量測定
* 動的粘弾性測定
* 熱重量分析
9. **バイオ医薬品受託試験サービス市場:技術別**
* クロマトグラフィー
* ガスクロマトグラフィー
* 高速液体クロマトグラフィー
* 超高速液体クロマトグラフィー
* ELISA
* 競合
* 間接
* サンドイッチ
* 質量分析
* GC-MS
* LC-MS
* PCR
* qPCR
* RT-PCR
* 分光法
* フーリエ変換赤外
* 核磁気共鳴
* 紫外可視
10. **バイオ医薬品受託試験サービス市場:用途別**
* 学術研究
* 基礎研究
* 橋渡し研究
* バイオテクノロジー
* 細胞治療
* 遺伝子治療
* 食品安全
* 汚染物質検出
* 栄養分析
* 医薬品
* 創薬
* プロセス開発
* 品質管理
11. **バイオ医薬品受託試験サービス市場:エンドユーザー別**
* 学術機関
* 研究機関
* 大学
* バイオテクノロジー企業
* 大手バイオテクノロジー企業
* 中小バイオテクノロジー企業
* 受託研究機関 (CROs)
* 大手CROs
* 中小CROs
* 製薬企業
* ジェネリック医薬品
* イノベーター (新薬開発企業)
12. **バイオ医薬品受託試験サービス市場:サンプルタイプ別**
* 細胞培養
* 哺乳類細胞培養
* 微生物細胞培養
* モノクローナル抗体
* キメラ
* ヒト化
* マウス
* ペプチド
* 天然ペプチド
* 合成ペプチド
* タンパク質
* 構造タンパク質
* 治療用タンパク質
* ワクチン
* 細菌ワクチン
* 組換えワクチン
* ウイルスワクチン
13. **バイオ医薬品受託試験サービス市場:地域別**
* 米州
* 北米
* 中南米
* 欧州、中東、アフリカ
* 欧州
* 中東
* アフリカ
* アジア太平洋
14. **バイオ医薬品受託試験サービス市場:グループ別**
* ASEAN
* GCC
* 欧州連合
* BRICS
* G7
* NATO
15. **バイオ医薬品受託試験サービス市場:国別**
* 米国
* カナダ
* メキシコ
* ブラジル
* 英国
* ドイツ
* フランス
* ロシア
* イタリア
* スペイン
* 中国
* インド
* 日本
* オーストラリア
* 韓国
16. **競合状況**
* 市場シェア分析、2024年
* FPNVポジショニングマトリックス、2024年
* 競合分析
* Abbott Laboratories
* Agilent Technologies Inc
* Bio-Rad Laboratories Inc
* bioMérieux SA
* Charles River Laboratories International Inc
* Danaher Corporation
* Eurofins Scientific SE
* F. Hoffmann-La Roche Ltd
* 富士フイルム株式会社 (FUJIFILM Corporation)
* GenScript Biotech Corp
* Gilead Sciences Inc
* ICON plc
* Intertek Group plc
* IQVIA Holdings Inc
* Laboratory Corporation of America Holdings
* Lonza Group Ltd
* Merck KGaA
* Pace Analytical Services Inc
* Samsung Biologics
* Sartorius AG
* SGS SA
* Syngene International Limited
* Thermo Fisher Scientific Inc
* Toxikon Corporation
* WuXi AppTec Co Ltd
17. **図目次** [合計: 30]
18. **表目次** [合計: 2343]
*** 本調査レポートに関するお問い合わせ ***

バイオ医薬品受託試験サービスは、近年急速に発展を遂げるバイオ医薬品の研究開発において、その複雑性と厳格な規制要件に対応するための不可欠な支援を提供する専門サービスです。従来の低分子医薬品とは異なり、タンパク質、抗体、核酸、細胞、遺伝子など、生体由来の物質を有効成分とするバイオ医薬品は、その構造が複雑で、製造工程も高度な技術を要します。そのため、開発のあらゆる段階において、高度な専門知識と特殊な設備を用いた多岐にわたる試験が求められ、製薬企業がこれら全てを自社内で賄うことは、莫大な投資と人的リソースを必要とします。こうした背景から、外部の専門機関に試験業務を委託する受託試験サービスが、開発期間の短縮、コストの最適化、そして品質と信頼性の確保に貢献する重要な役割を担っています。
具体的には、バイオ医薬品受託試験サービスは、前臨床段階から臨床試験、さらには製造販売後の品質管理に至るまで、幅広いフェーズで提供されます。例えば、医薬品候補物質の特性解析においては、構造解析、品質評価、安定性試験、不純物分析、効力試験などが実施されます。これらの試験は、医薬品の同一性、純度、力価、安全性、そして有効性を科学的に証明するために不可欠であり、特にバイオ医薬品においては、その複雑な分子構造や生物学的活性を正確に評価するための高度な分析技術が要求されます。また、非臨床試験においては、動物を用いた安全性薬理試験や毒性試験を通じて、ヒトへの投与におけるリスクを評価し、臨床試験への移行の可否を判断する重要なデータを提供します。さらに、臨床試験段階では、検体分析や薬物動態(PK)/薬力学(PD)解析、免疫原性評価など、ヒトにおける安全性と有効性を確認するための試験が実施され、これらのデータは医薬品の承認申請において極めて重要な根拠となります。
製薬企業が受託試験サービスを利用する最大のメリットは、自社のコア業務である研究開発や販売戦略に集中できる点にあります。高度な専門知識を持つ外部機関に試験業務を委託することで、自社での設備投資や専門人材の育成にかかる負担を軽減し、開発コストを抑制することが可能となります。また、受託機関は複数の製薬企業から依頼を受けることで、最新の技術やノウハウを蓄積し、効率的かつ高品質な試験サービスを提供できる体制を構築しています。これにより、製薬企業は常に最先端の技術と専門性を活用でき、開発期間の短縮と市場投入までの時間を早めることにも繋がります。さらに、国内外の規制当局(PMDA、FDA、EMAなど)の厳格なガイドライン(GLP、GMP、GCPなど)に準拠した品質管理体制を持つ受託機関を選ぶことで、データ信頼性の確保と承認申請プロセスの円滑化が期待できます。
バイオ医薬品受託試験サービスを提供する機関の選定にあたっては、その専門性、実績、品質管理体制、規制当局対応能力、そしてコミュニケーション能力が重要な判断基準となります。特に、バイオ医薬品の特性を深く理解し、複雑な試験デザインに対応できる技術力と、予期せぬ問題発生時にも迅速かつ的確な解決策を提案できる柔軟性が求められます。また、機密性の高い研究開発情報を扱うため、情報セキュリティ体制も極めて重要です。近年、バイオ医薬品市場の拡大に伴い、受託試験サービスの需要は一層高まっており、各サービスプロバイダーは、遺伝子治療薬や細胞治療薬といった次世代バイオ医薬品に対応するための新たな技術開発や設備投資を積極的に進めています。このように、バイオ医薬品受託試験サービスは、単なる外部委託先ではなく、製薬企業の研究開発戦略における不可欠なパートナーとして、その重要性を増しており、革新的な医薬品を患者のもとへ届けるための重要な役割を担い続けています。