世界の神経変性疾患医薬品市場の規模、シェア、トレンド、成長、および予測(2025年~2032年)

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
## 神経変性疾患医薬品市場の規模と動向に関する詳細分析
### 市場概要
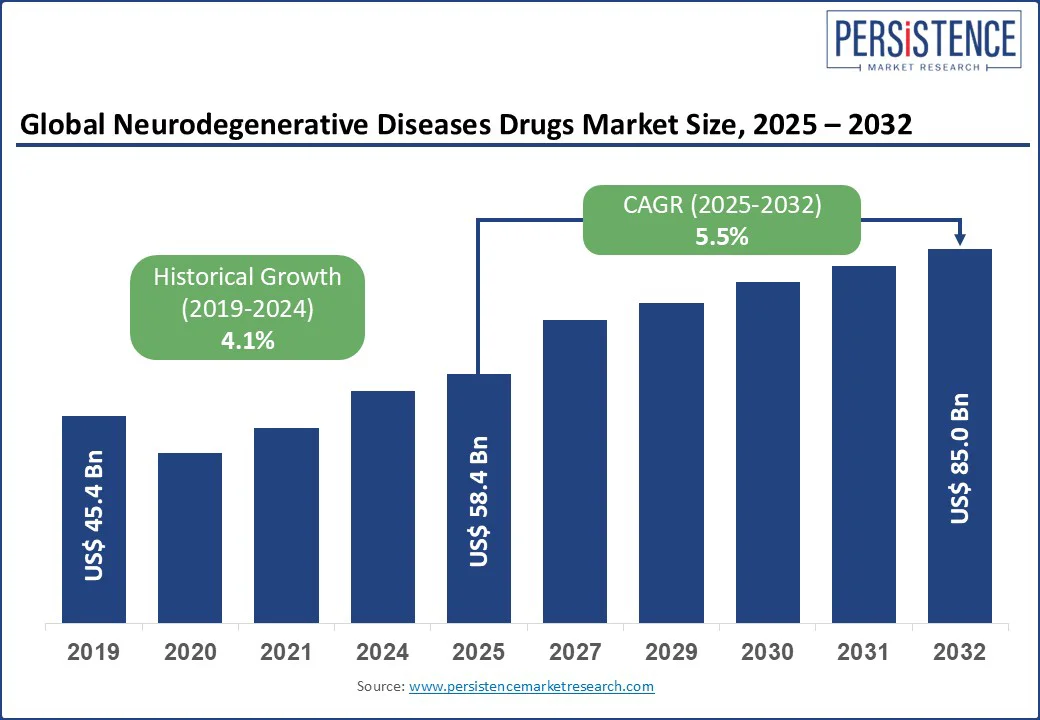
神経変性疾患医薬品市場は、2025年には584億米ドルの規模に達すると予測されており、2032年には850億米ドルに成長し、予測期間(2025年~2032年)中に年平均成長率(CAGR)5.5%で拡大すると見込まれています。過去の市場成長率(2019年~2024年)は4.1%でした。この成長は、画期的な規制承認、バイオマーカーに基づく精密な標的治療の進展、そして疾患修飾療法の需要増加によって強く推進されています。
高齢化の進展は、アルツハイマー病、パーキンソン病、多発性硬化症といった主要な神経変性疾患の罹患率を押し上げています。これに対応し、製薬企業は研究開発の優先順位を見直し、高付加価値の生物製剤、免疫調節剤、再生医療プラットフォームへの投資を強化しています。さらに、研究開発への投資増加、国境を越えた共同研究、そして医療費支払者との連携が、神経変性疾患領域を世界の神経学市場における主要な成長フロンティアとして位置づけています。
**主要な業界ハイライトと市場トレンド:**
* **治療パラダイムの転換:** 従来の対症療法から、標的型免疫調節療法や生物製剤へと治療アプローチが大きくシフトしています。これは、疾患の根本原因にアプローチし、進行を遅らせる、あるいは停止させることを目指すものです。
* **医療費支出と償還制度の改善:** 神経疾患ケアに対する医療費支出の増加と、新たな治療法を支持する償還制度の整備が、市場成長を後押しすると予想されます。特に、高価な革新的治療薬に対する償還の可否が、市場へのアクセスを大きく左右します。
* **パーキンソン病における新たな治療機会:** パーキンソン病の非運動症状(うつ病、認知障害、睡眠障害など)を標的とした治療法の開発は、新たな成長機会を創出すると期待されています。これにより、患者の生活の質が大幅に向上する可能性があります。
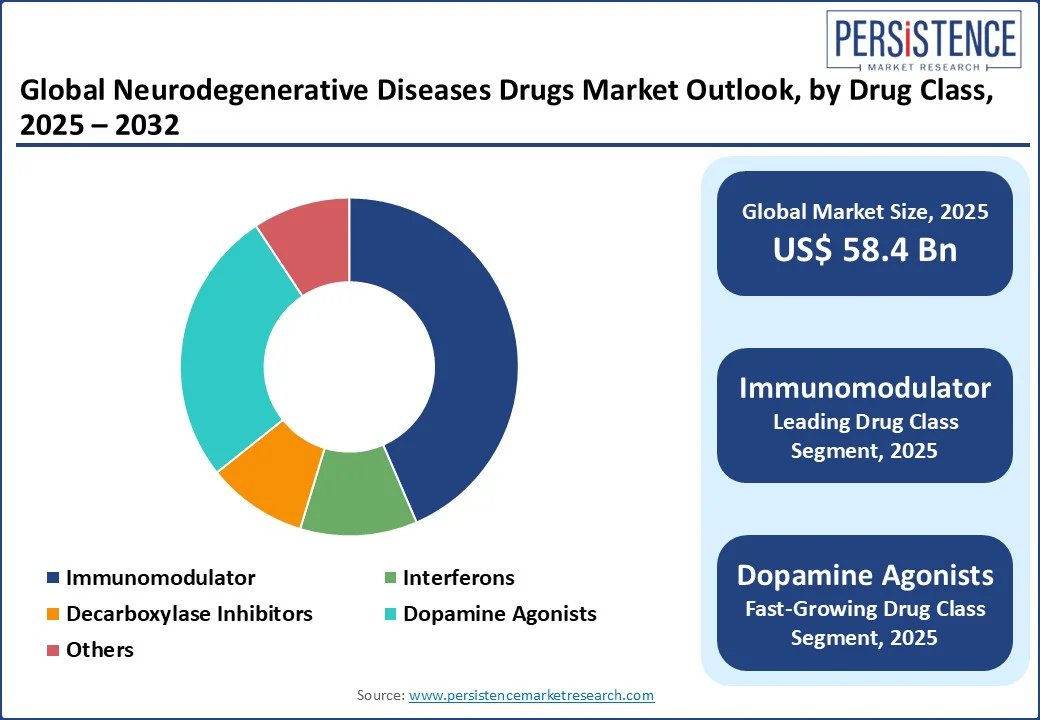
* **免疫調節剤の優位性:** 免疫調節剤は、2025年には市場全体の約43.5%のシェアを占めると予測されています。これは、様々な神経炎症性疾患の中心的な炎症経路を抑制する効果が証明されているためです。
* **多発性硬化症の市場牽引:** 多発性硬化症は、一貫した研究資金、強力な患者擁護活動、そして新薬の早期導入が継続的な開発を後押ししていることから、依然として主要な疾患適応症として市場を牽引しています。
* **北米における診断インフラの進展:** 早期段階での治療と薬剤適格性を支援する独自の診断インフラの発展が、北米市場の成長を推進しています。これにより、適切な患者に適切なタイミングで治療を提供することが可能になります。
### 市場の動向
#### 推進要因:早期診断が革新的治療薬の需要を押し上げる
神経変性疾患医薬品市場の成長を加速させる主要な推進要因の一つは、早期診断と早期介入への重点の高まりです。これにより、治療対象となる患者層が拡大しています。
エーザイとバイオジェンが開発したレカネマブが米国、日本、および一部の欧州諸国で早期アルツハイマー病治療薬として承認されたことは、早期スクリーニングの需要を劇的に増加させました。この承認は、医療機関がPETイメージング、脳脊髄液(CSF)バイオマーカー検査、血液ベースの診断法といった高度な診断技術への投資を促しています。このパラダイムシフトにより、不可逆的な神経細胞損傷が発生する前に病態生理学的メカニズムを標的とする薬剤への需要が飛躍的に高まっています。
イーライリリー社のドナネマブが、TRAILBLAZER-ALZ 2試験において、早期段階のアルツハイマー病患者の認知機能低下を35%遅らせる効果を示したことは、前臨床段階または軽度認知障害(MCI)段階で投与された場合の有効性が非常に高いことを実証しました。このような臨床試験の結果は、医療費支払者や医療機関がバイオマーカーによる確定診断に裏付けられた治療法に対して、より積極的に償還を行う傾向を強めています。この動きは、製薬企業が自社のパイプラインを前駆期(prodromal-stage)の治療薬開発に集中させる直接的な動機となっています。早期診断技術の進歩と、それに対応する疾患修飾療法の開発は、神経変性疾患の治療戦略を根本から変革し、患者の予後改善に大きく貢献すると期待されています。
#### 抑制要因:償還制度の偏りと診断ギャップが新薬の普及を阻害
神経変性疾患医薬品市場における新薬、特に疾患修飾療法の普及を妨げる主要な抑制要因は、償還制度の偏りと診断インフラのギャップです。
歴史的に、神経変性疾患の治療は対症療法に大きく依存してきました。アルツハイマー病に対するドネペジルやパーキンソン病に対するレボドパなど、既存の多くの治療法は、疾患の進行パターンを変えることなく一時的な症状緩和を提供するに過ぎません。この治療モデルは、最新の薬剤の長期的な価値について、臨床医や患者の間で懐疑的な見方を醸成してきました。疾患の生物学的メカニズムに早期介入するのではなく、症状を管理する傾向が強かったため、疾患修飾療法に不可欠な診断インフラへの投資も限定的でした。
多くの革新的な治療法は、バイオマーカーによる確定診断を必要とします。しかし、アルツハイマー病協会が2024年に実施した調査によると、米国の神経科医の30%未満しか、費用、アクセス制限、および治療への具体的な行動への不確実性を理由に、アミロイドPETスキャンやCSF検査を日常的に指示していません。この診断ギャップは深刻であり、たとえ疾患修飾薬が承認されたとしても、それをサポートするシステムがなければ、実世界での導入が困難になるという事態を招いています。さらに、多くの地域の償還制度は依然として、低コストで確立された対症療法を優遇する傾向にあります。これは、高価な新規治療薬の普及を阻害し、患者が革新的な治療にアクセスする機会を制限する要因となっています。この償還制度の偏りと診断インフラの未整備は、新薬開発のインセンティブを低下させ、神経変性疾患治療の進歩を遅らせる大きな障壁となっています。
#### 機会:幹細胞開発が新たな医薬品パイプラインを推進
神経変性疾患における再生医療アプローチとしての幹細胞療法の探求は、医薬品開発者に新たな大きな機会を創出しています。この分野の進展は、治療の焦点が対症療法から実際の神経細胞の修復へと徐々にシフトしていることを示しています。
幹細胞ベースの介入は、損傷した神経回路を再構築し、長期的な疾患修飾効果を提供することを目指しています。これは、製薬およびバイオテクノロジー企業が、幹細胞の有効性を向上させる薬剤を共同開発したり、免疫調節剤や低分子化合物を含む併用療法を開発して、細胞生着に適した宿主環境を整えたりすることを促しています。
最近の臨床試験は、この大きな可能性を強調しています。例えば、バイエル子会社であるBlueRock Therapeuticsは、2024年にパーキンソン病を対象としたドーパミン産生iPSC由来細胞療法の第2相臨床試験を米国とカナダで開始しました。この治療法の第1相試験の早期結果では、安全性だけでなく、参加者の運動機能改善の兆候も示されました。このような有望な結果は、神経炎症や酸化ストレスを軽減する補助薬の開発に対する関心を刺激しています。幹細胞療法は、神経変性疾患の根本的な治療法として、病状の進行を遅らせるだけでなく、失われた機能を回復させる可能性を秘めています。この分野の進展は、神経変性疾患医薬品市場に革命をもたらし、これまで治療が困難であった疾患に対する新たな希望を提供するものとして注目されています。
### カテゴリー別分析
#### 薬剤クラス別インサイト
薬剤クラス別では、神経変性疾患医薬品市場は免疫調節剤、インターフェロン、デカルボキシラーゼ阻害剤、ドーパミンアゴニスト、その他に分類されます。
* **免疫調節剤:** 2025年には神経変性疾患医薬品市場の約43.5%のシェアを占めると予測されており、神経炎症や免疫調節不全といった疾患の中核メカニズムを標的とする能力により、市場をリードしています。多発性硬化症のように明確な自己免疫基盤を持つ疾患においては、免疫調節剤が治療の主軸となっています。このクラスの薬剤は、規制当局による承認実績と、バイオマーカーを用いた患者層別化が可能であることによって、その魅力がさらに高まっています。
* **ドーパミンアゴニスト:** パーキンソン病の治療において勢いを増しています。これは、従来のレボドパベースの治療法と比較して、治療用途の拡大、送達メカニズムの改善、および長期的な合併症の軽減が期待されるためです。レボドパは症状緩和のゴールドスタンダードであるものの、長期使用は運動合併症(ウェアリングオフ現象やジスキネジア)と関連しています。プラミペキソール、ロピニロール、ロチゴチンなどのドーパミンアゴニストは、レボドパの開始を遅らせるために早期パーキンソン病で使用されることが増えています。
#### 疾患適応症別インサイト
疾患適応症別では、市場は多発性硬化症、パーキンソン病、アルツハイマー病、脊髄性筋萎縮症(SMA)、その他に分けられます。
* **多発性硬化症:** 2025年には市場シェアの約62.6%を占めると予測されており、その明確な自己免疫病理、利用可能なバイオマーカー、および明確な臨床エンドポイントの存在により、市場を牽引しています。多発性硬化症は脱髄と神経炎症を特徴とし、免疫調節療法によく反応します。これにより、世界中で20種類以上の疾患修飾療法(DMTs)が承認されています。
* **アルツハイマー病:** 膨大な患者負担、政治的な可視性、そして疾患修飾療法の画期的な進歩に関連する商業的インセンティブにより、主要な疾患適応症として際立っています。アルツハイマー病協会によると、米国では700万人以上がこの疾患を抱えており、2050年までにその数は約1300万人に急増すると推定されています。この疫学的圧力は、公衆衛生上の課題と製薬企業のパイプラインの両方において、アルツハイマー病を最前線に押し上げています。
### 地域別インサイト
#### 北米の神経変性疾患医薬品市場動向
北米は、2025年には市場シェアの約51.8%を占めると予測されており、公的資金の増加、規制承認プロセスの迅速化、および満たされていない高い医療ニーズがその主要因です。
* **米国:** エーザイとバイオジェンが開発したレカネマブ(Leqembi)が、早期アルツハイマー病に対する初の完全承認された抗アミロイド薬としてFDAの承認を得たことは、米国神経変性疾患医薬品市場にとって画期的な出来事でした。メディケア・メディケイドサービスセンター(CMS)もそれに続き、適用範囲を拡大しました。これにより、疾患修飾療法に対する政策支援が強化され、米国の投資フローと価格戦略に影響を与え始めています。
* **カナダ:** カナダも新規治療法への開放性を示しており、2023年後半にはHealth Canadaがレカネマブを承認しました。しかし、米国と比較して償還ガイドラインが限定的であり、これは同国の厳格な費用対効果の基準を反映しています。北米全体として、高度な医療インフラと強力な研究開発エコシステムが市場成長を支えています。
#### 欧州の神経変性疾患医薬品市場動向
欧州市場は、厳格な規制基準、費用対効果の閾値、および公共部門の関与の増加によって特徴づけられます。
* **欧州医薬品庁(EMA):** 2024年11月には、バイオジェンとエーザイのレカネマブに対し条件付き販売承認を付与しました。しかし、ドイツやフランスは、臨床的利益と長期的な経済的価値に関する未解決の懸念から、国内の償還制度への統合が遅れています。ドイツ連邦合同委員会(G-BA)は2025年初頭にレカネマブを評価し、「軽微な追加的利益」と評価しました。これは、価格交渉とアクセスまでの期間に影響を与えています。
* **研究開発投資:** 欧州では、高齢化する人口における治療効果をより適切に評価するため、分散型臨床試験やリアルワールドデータ(RWD)インフラへの投資が増加しています。Horizon Europeの下で2022年に立ち上げられたInnovative Health Initiative(IHI)は、神経変性疾患研究に1億ユーロ以上を投じており、NEUROCUREやEuropean Platform for Neurodegenerative Diseases (EPND) などのプロジェクトを通じて、バイオマーカーの検証と国境を越えたデータ共有の調和を目指しています。欧州の医療システムは多様で複雑であり、各国の償還政策が市場アクセスに大きな影響を与えます。
#### アジア太平洋地域の神経変性疾患医薬品市場動向
アジア太平洋地域は、人口動態の変化、政府支援の研究インセンティブ、および地域内での開発の増加により、急速に進化しています。
* **日本:** 医薬品開発と規制の迅速性の両面で、地域の最前線を走っています。2023年9月には、日本の医薬品医療機器総合機構(PMDA)が早期アルツハイマー病治療薬としてレカネマブ(Leqembi)を承認しました。これは米国での承認からわずか数ヶ月後のことであり、PMDAはこれを国民健康保険制度の対象にも含めました。これは、日本の認知症に対する緊急の焦点に対応する迅速な決定と見なされています。
* **中国:** 「健康中国2030」イニシアティブの下で、神経変性疾患の創薬に投資しています。Green Valley Pharmaceuticalsのような企業は、海洋藻類由来のアルツハイマー病治療薬GV-971で注目を集めており、2025年初頭にはアジア太平洋、北米、欧州でグローバル第3相試験を実施すると発表しました。
* **韓国:** 精密医療のハブとして台頭しており、PeptronやMedytoxなどのバイオテクノロジー企業が、神経変性疾患に対するペプチドおよびボツリヌス毒素ベースの治療法を開発しています。アジア太平洋地域は、巨大な患者人口と経済成長、そして政府の支援増加により、神経変性疾患医薬品市場にとって非常に有望な地域となっています。
### 競争環境
神経変性疾患医薬品市場は、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)、ハンチントン病といった疾患の負担が増大していることから、非常に細分化されています。
大手製薬企業は、後期段階のパイプライン資産とFDA承認済みの治療薬によって市場を支配しています。一方、小規模企業は、血液脳関門を通過する生物製剤やリソソーム機能を調節する低分子化合物など、独自のモダリティを持つ候補薬の開発を推進しています。また、特に希少疾患や遺伝的に定義された疾患に対して、遺伝子治療やアンチセンスオリゴヌクレオチドに対する関心が急増しています。次世代の神経変性疾患医薬品を開発するため、大手製薬企業と小規模バイオテクノロジー企業との間の戦略的提携も勢いを増しています。これは、技術革新と市場アクセスを両立させるための重要な戦略となっています。
**主要な業界動向:**
* **2025年7月:** Klotho Neurosciencesは、筋萎縮性側索硬化症(ALS)治療のための独自の分泌型Klothoプロモーター遺伝子治療薬KLTO-202に対し、FDAからオーファン・ドラッグ指定を受けました。この指定により、7年間の市場独占権、GDUFAユーザーフィーの免除、臨床試験に対する税額控除などの重要な利点が得られます。
* **2025年3月:** Alpha Cognition Inc.は、軽度から中等度のアルツハイマー病に対する新治療薬ZUNVEYLの公式商業販売を開始したと発表しました。この発売により、同社は患者と介護者に対し革新的でアクセスしやすいソリューションを提供することを目指しています。
**神経変性疾患医薬品市場をカバーする企業:**
* Biogen
* Pfizer, Inc.
* Hoffmann-La Roche Ltd.
* Merck & Co., Inc.
* Novartis AG
* Sanofi
* Teva Pharmaceutical Industries Ltd.
* Orion Pharma
* UCB S.A
* ACADIA Pharmaceuticals Inc.
* Lundbeck A/S
* Mitsubishi Tanabe Pharma Corporation
* その他
これらの企業は、革新的な医薬品の開発と市場投入を通じて、神経変性疾患に苦しむ患者の生活の質を向上させるために競争し、協力しています。市場のダイナミクスは、科学的進歩、規制環境の変化、および医療ニーズの進化によって常に変化しています。
Report Coverage & Structure
Executive Summary
- 世界の神経変性疾患医薬品市場概要、2025年および2032年
- 市場機会評価、2025年~2032年、US$ Bn
- 主要な市場トレンド
- 将来の市場予測
- プレミアム市場インサイト
- 業界の動向と主要な市場イベント
- PMR分析と推奨事項
Market Overview
- 市場範囲と定義
- 市場のダイナミクス
- 推進要因
- 阻害要因
- 機会
- 課題
- 主要なトレンド
- マクロ経済的要因
- 神経変性疾患の有病率の増加
- 研究活動改善のための政府の取り組み
- COVID-19影響分析
- 予測要因 – 関連性と影響
Value Added Insights
- 規制環境
- 薬剤クラス採用分析
- 主要な取引と合併
- PESTLE分析
- ポーターの5つの力分析
Global Neurodegenerative Diseases Drugs Market Outlook
- 主要なハイライト
- 市場規模(US$ Bn)と前年比成長率
- 絶対的な$機会
- 市場規模(US$ Bn)分析と予測
- 過去の市場規模(US$ Bn)分析、2019年~2024年
- 市場規模(US$ Bn)分析と予測、2025年~2032年
- 世界の神経変性疾患医薬品市場見通し:薬剤クラス別
- はじめに / 主要な調査結果
- 過去の市場規模(US$ Bn)分析、薬剤クラス別、2019年~2024年
- 市場規模(US$ Bn)分析と予測、薬剤クラス別、2025年~2032年
- 免疫調節薬
- インターフェロン
- 脱炭酸酵素阻害薬
- ドーパミンアゴニスト
- その他
- 市場魅力度分析:薬剤クラス別
- 世界の神経変性疾患医薬品市場見通し:疾患適応症別
- はじめに / 主要な調査結果
- 過去の市場規模(US$ Bn)分析、疾患適応症別、2019年~2024年
- 市場規模(US$ Bn)分析と予測、疾患適応症別、2025年~2032年
- 多発性硬化症
- パーキンソン病
- アルツハイマー病
- 脊髄性筋萎縮症(SMA)
- その他
- 市場魅力度分析:疾患適応症別
- 世界の神経変性疾患医薬品市場見通し:投与経路別
- はじめに / 主要な調査結果
- 過去の市場規模(US$ Bn)分析、投与経路別、2019年~2024年
- 市場規模(US$ Bn)分析と予測、投与経路別、2025年~2032年
- 経口
- 注射
- 経皮
- 市場魅力度分析:投与経路別
- 世界の神経変性疾患医薬品市場見通し:最終用途別
- はじめに / 主要な調査結果
- 過去の市場規模(US$ Bn)分析、最終用途別、2019年~2024年
- 市場規模(US$ Bn)分析と予測、最終用途別、2025年~2032年
- 病院薬局
- 小売薬局
- オンライン薬局
- 市場魅力度分析:最終用途別
Global Neurodegenerative Diseases Drugs Market Outlook: Region
- 主要なハイライト
- 過去の市場規模(US$ Bn)分析、地域別、2019年~2024年
- 市場規模(US$ Bn)分析と予測、地域別、2025年~2032年
- 北米
- 欧州
- 東アジア
- 南アジアおよびオセアニア
- ラテンアメリカ
- 中東およびアフリカ
- 市場魅力度分析:地域別
North America Neurodegenerative Diseases Drugs Market Outlook
- 主要なハイライト
- 過去の市場規模(US$ Bn)分析、市場別、2019年~2024年
- 国別
- 薬剤クラス別
- 疾患適応症別
- 投与経路別
- 最終用途別
- 市場規模(US$ Bn)分析と予測、国別、2025年~2032年
- 米国
- カナダ
- 市場規模(US$ Bn)分析と予測、薬剤クラス別、2025年~2032年
- 免疫調節薬
- インターフェロン
- 脱炭酸酵素阻害薬
- ドーパミンアゴニスト
- その他
- 市場規模(US$ Bn)分析と予測、疾患適応症別、2025年~2032年
- 多発性硬化症
- パーキンソン病
- アルツハイマー病
- 脊髄性筋萎縮症(SMA)
- その他
- 市場規模(US$ Bn)分析と予測、投与経路別、2025年~2032年
- 経口
- 注射
- 経皮
- 市場規模(US$ Bn)分析と予測、最終用途別、2025年~2032年
- 病院薬局
- 小売薬局
- オンライン薬局
- 市場魅力度分析
Europe Neurodegenerative Diseases Drugs Market Outlook
- 主要なハイライト
- 過去の市場規模(US$ Bn)分析、市場別、2019年~2024年
- 国別
- 薬剤クラス別
- 疾患適応症別
- 投与経路別
- 最終用途別
- 市場規模(US$ Bn)分析と予測、国別、2025年~2032年
- ドイツ
- フランス
- 英国
- イタリア
- スペイン
- ロシア
- トルコ
- その他の欧州諸国
- 市場規模(US$ Bn)分析と予測、薬剤クラス別、2025年~2032年
- 免疫調節薬
- インターフェロン
- 脱炭酸酵素阻害薬
- ドーパミンアゴニスト
- その他
- 市場規模(US$ Bn)分析と予測、疾患適応症別、2025年~2032年
- 多発性硬化症
- パーキンソン病
- アルツハイマー病
- 脊髄性筋萎縮症(SMA)
- その他
- 市場規模(US$ Bn)分析と予測、投与経路別、2025年~2032年
- 経口
- 注射
- 経皮
- 市場規模(US$ Bn)分析と予測、最終用途別、2025年~2032年
- 病院薬局
- 小売薬局
- オンライン薬局
- 市場魅力度分析
East Asia Neurodegenerative Diseases Drugs Market Outlook
- 主要なハイライト
- 過去の市場規模(US$ Bn)分析、市場別、2019年~2024年
- 国別
- 薬剤クラス別
- 疾患適応症別
- 投与経路別
- 最終用途別
- 市場規模(US$ Bn)分析と予測、国別、2025年~2032年
- 中国
- 日本
- 韓国
- 市場規模(US$ Bn)分析と予測、薬剤クラス別、2025年~2032年
- 免疫調節薬
- インターフェロン
- 脱炭酸酵素阻害薬
- ドーパミンアゴニスト
- その他
- 市場規模(US$ Bn)分析と予測、疾患適応症別、2025年~2032年
- 多発性硬化症
- パーキンソン病
- アルツハイマー病
- 脊髄性筋萎縮症(SMA)
- その他
- 市場規模(US$ Bn)分析と予測、投与経路別、2025年~2032年
- 経口
- 注射
- 経皮
- 市場規模(US$ Bn)分析と予測、最終用途別、2025年~2032年
- 病院薬局
- 小売薬局
- オンライン薬局
- 市場魅力度分析
South Asia & Oceania Neurodegenerative Diseases Drugs Market Outlook
- 主要なハイライト
- 過去の市場規模(US$ Bn)分析、市場別、2019年~2024年
- 国別
- 薬剤クラス別
- 疾患適応症別
- 投与経路別
- 最終用途別
- 市場規模(US$ Bn)分析と予測、国別、2025年~2032年
- インド
- 東南アジア
- オーストラリア・ニュージーランド
- その他の南アジアおよびオセアニア諸国
- 市場規模(US$ Bn)分析と予測、薬剤クラス別、2025年~2032年
- 免疫調節薬
- インターフェロン
- 脱炭酸酵素阻害薬
- ドーパミンアゴニスト
- その他
- 市場規模(US$ Bn)分析と予測、疾患適応症別、2025年~2032年
- 多発性硬化症
- パーキンソン病
- アルツハイマー病
- 脊髄性筋萎縮症(SMA)
- その他
- 市場規模(US$ Bn)分析と予測、投与経路別、2025年~2032年
- 経口
- 注射
- 経皮
- 市場規模(US$ Bn)分析と予測、最終用途別、2025年~2032年
- 病院薬局
- 小売薬局
- オンライン薬局
- 市場魅力度分析
Latin America Neurodegenerative Diseases Drugs Market Outlook
- 主要なハイライト
- 過去の市場規模(US$ Bn)分析、市場別、2019年~2024年
- 国別
- 薬剤クラス別
- 疾患適応症別
- 投与経路別
- 最終用途別
- 市場規模(US$ Bn)分析と予測、国別、2025年~2032年
- ブラジル
- メキシコ
- その他のラテンアメリカ諸国
- 市場規模(US$ Bn)分析と予測、薬剤クラス別、2025年~2032年
- 免疫調節薬
- インターフェロン
- 脱炭酸酵素阻害薬
- ドーパミンアゴニスト
- その他
- 市場規模(US$ Bn)分析と予測、疾患適応症別、2025年~2032年
- 多発性硬化症
- パーキンソン病
- アルツハイマー病
- 脊髄性筋萎縮症(SMA)
- その他
- 市場規模(US$ Bn)分析と予測、投与経路別、2025年~2032年
- 経口
- 注射
- 経皮
- 市場規模(US$ Bn)分析と予測、最終用途別、2025年~2032年
- 病院薬局
- 小売薬局
- オンライン薬局
- 市場魅力度分析
Middle East & Africa Neurodegenerative Diseases Drugs Market Outlook
- 主要なハイライト
- 過去の市場規模(US$ Bn)分析、市場別、2019年~2024年
- 国別
- 薬剤クラス別
- 最終用途別
- 市場規模(US$ Bn)分析と予測、国別、2025年~2032年
- GCC諸国
- エジプト
- 南アフリカ
- 北アフリカ
- その他の中東およびアフリカ諸国
- 市場規模(US$ Bn)分析と予測、薬剤クラス別、2025年~2032年
- 免疫調節薬
- インターフェロン
- 脱炭酸酵素阻害薬
- ドーパミンアゴニスト
- その他
- 市場規模(US$ Bn)分析と予測、疾患適応症別、2025年~2032年
- 多発性硬化症
- パーキンソン病
- アルツハイマー病
- 脊髄性筋萎縮症(SMA)
- その他
- 市場規模(US$ Bn)分析と予測、投与経路別、2025年~2032年
- 経口
- 注射
- 経皮
- 市場規模(US$ Bn)分析と予測、最終用途別、2025年~2032年
- 病院薬局
- 小売薬局
- オンライン薬局
- 市場魅力度分析
Competition Landscape
- 市場シェア分析、2025年
- 市場構造
- 市場別競合強度マッピング
- 競合ダッシュボード
- 企業プロファイル(詳細 – 概要、財務、戦略、最近の動向)
- バイオジェン
- 概要
- セグメントと薬剤クラス
- 主要な財務情報
- 市場の動向
- 市場戦略
- ファイザー株式会社
- ホフマン・ラ・ロシュ株式会社
- メルク・アンド・カンパニー株式会社
- ノバルティスAG
- サノフィ
- テバ製薬工業株式会社
- オリオンファーマ
- UCB S.A
- アカディア・ファーマシューティカルズ株式会社
- ルンドベックA/S
- 田辺三菱製薬株式会社
- その他
- バイオジェン
Appendix
- 調査方法
- 調査の前提条件
- 頭字語と略語
*** 本調査レポートに関するお問い合わせ ***

「神経変性疾患医薬品」とは、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)、ハンチントン病など、神経細胞が徐々に変性・脱落していくことで発症する疾患群の治療に用いられる薬剤の総称であります。これらの疾患は、多くの場合、進行性で不可逆的な神経機能の障害を引き起こし、患者様の生活の質を著しく低下させ、最終的には生命を脅かすことも少なくありません。現在、その多くが根本的な治療法を持たず、対症療法が中心であるため、医療現場におけるアンメットメディカルニーズが極めて高い分野として認識されております。神経変性疾患の病態は多岐にわたり、特定のタンパク質の異常凝集、ミトコンドリア機能不全、酸化ストレス、神経炎症、遺伝的要因などが複雑に絡み合っていると考えられており、これらの複雑なメカニズムを標的とした医薬品の開発は、現代医学における最も困難かつ重要な課題の一つとされています。
定義
神経変性疾患医薬品の定義は、その対象となる疾患の特性と密接に関連しています。神経変性疾患は、脳や脊髄の特定の神経細胞群が時間とともに機能不失に陥り、最終的に死滅していく進行性の疾患群を指します。この過程は、認知機能の低下、運動機能の障害、感覚異常、精神症状など、多様な臨床症状として現れます。例えば、アルツハイマー病ではアミロイドβやタウタンパク質の異常蓄積、パーキンソン病ではα-シヌクレインの凝集とドーパミン作動性ニューロンの変性が主要な病理学的特徴として知られています。
これらの疾患に対する医薬品は、大きく分けて二つのカテゴリーに分類できます。一つは、症状を緩和し、患者様の生活の質を向上させることを目的とした「対症療法薬」です。例えば、アルツハイマー病におけるコリンエステラーゼ阻害薬やNMDA受容体拮抗薬、パーキンソン病におけるレボドパ製剤やドーパミンアゴニストなどがこれに該当します。これらの薬剤は、失われた神経伝達物質を補充したり、その作用を増強したりすることで、一時的に症状を改善しますが、病気の進行そのものを止めることはできません。
もう一つは、病気の進行を遅らせる、あるいは停止させることを目指す「疾患修飾薬(Disease-Modifying Therapies, DMTs)」です。これは、神経変性の根本原因に介入することを目的としており、特定の異常タンパク質の産生・凝集を抑制する、神経炎症を抑える、神経細胞の保護を促す、あるいは失われた神経細胞を再生させる、といったアプローチが研究されています。近年、アルツハイマー病に対する抗アミロイドβ抗体薬が承認され、疾患修飾薬の実現可能性を示す画期的な進展として注目を集めていますが、その効果や安全性については依然として議論が続いています。
神経変性疾患医薬品の開発は、その複雑な病態、診断の難しさ、治療効果の評価の困難さ、そして脳血液関門(BBB)の存在といった、多くの課題に直面しています。脳血液関門は、脳を外部の有害物質から保護する重要なバリアである一方で、薬剤が脳組織に到達するのを阻害するため、効果的な脳内移行性を有する薬剤の設計が不可欠です。また、疾患の進行が非常にゆっくりであるため、臨床試験には長期間と大規模な患者コホートが必要となり、開発コストも高騰する傾向にあります。これらの背景から、神経変性疾患医薬品の研究開発は、極めて高い専門性と長期的な視点が求められる分野であると言えます。
応用
神経変性疾患医薬品の応用は、各疾患の病態生理学的特徴に基づいて多岐にわたります。最も研究が進み、多くの薬剤が開発されているのはアルツハイマー病とパーキンソン病であり、これらに加えて筋萎縮性側索硬化症(ALS)やハンチントン病など、希少疾患に対する治療薬の開発も進められています。
アルツハイマー病においては、現在、コリンエステラーゼ阻害薬(ドネペジル、リバスチグミン、ガランタミン)とNMDA受容体拮抗薬(メマンチン)が標準的な対症療法として広く用いられています。これらの薬剤は、認知機能の低下を一時的に緩和し、行動心理症状を管理するのに役立ちます。近年、アミロイドβプラークの除去を標的としたモノクローナル抗体薬であるアデュカヌマブやレカネマブが承認され、疾患修飾薬として大きな期待が寄せられています。これらの抗体薬は、脳内のアミロイドβ凝集を減少させることで、病気の進行を遅らせる可能性が示唆されていますが、その臨床的意義や安全性プロファイルについては、さらなるデータ蓄積と評価が求められています。将来的には、タウタンパク質の異常、神経炎症、シナプス機能不全など、アルツハイマー病の多様な病態メカニズムを標的とした薬剤や、複数の経路に作用する複合療法の開発が期待されています。
パーキンソン病の治療においては、ドーパミン作動性ニューロンの変性によるドーパミン不足を補うことが中心となります。レボドパは最も効果的な薬剤であり、ドーパミンアゴニスト、MAO-B阻害薬、COMT阻害薬なども併用され、運動症状の管理に貢献しています。しかし、これらの薬剤は病気の進行を止めるものではなく、長期使用に伴う副作用(ジスキネジアなど)も課題となっています。疾患修飾療法としては、α-シヌクレインの凝集を標的とした抗体療法や低分子化合物、神経栄養因子を用いた遺伝子治療、リソソーム機能改善薬などが研究段階にあります。また、脳深部刺激療法(DBS)のような外科的治療も、薬物療法で十分な効果が得られない患者様に対して適用されています。
筋萎縮性側索硬化症(ALS)は、運動ニューロンが選択的に変性・脱落する難病であり、現在承認されている薬剤はリルゾールとエダラボンに限られています。これらの薬剤は病気の進行をわずかに遅らせる効果しかなく、根本的な治療には至っていません。近年、特定の遺伝子変異(SOD1変異)を持つALS患者様に対して、その遺伝子発現を抑制するアンチセンスオリゴヌクレオチド(ASO)であるトフェルセンが承認され、個別化医療の可能性を示しました。また、神経炎症や酸化ストレスを標的とした複合薬も開発が進められています。
ハンチントン病は、ハンチンチンタンパク質の遺伝子変異によって引き起こされる遺伝性疾患であり、不随意運動(舞踏病)や認知機能障害、精神症状を特徴とします。現在、テトラベナジンやデュテトラベナジンなどのVMAT2阻害薬が舞踏病症状の緩和に用いられていますが、疾患の進行を遅らせる効果はありません。疾患修飾療法としては、変異ハンチンチンタンパク質の産生を抑制するASOや遺伝子サイレンシング技術を用いた治療法が臨床試験段階にあり、大きな期待が寄せられています。
これらの主要疾患以外にも、進行性核上性麻痺(PSP)、多系統萎縮症(MSA)、前頭側頭型認知症(FTD)など、他の神経変性疾患に対しても、それぞれの病態メカニズムに基づいた新たな薬剤の開発が精力的に進められています。細胞治療(幹細胞移植など)や遺伝子治療、そして脳内への薬剤送達システム(DDS)の改良も、神経変性疾患医薬品の応用範囲を広げる重要なアプローチとして研究が進められています。
動向
神経変性疾患医薬品の研究開発は、近年、目覚ましい進展を遂げており、いくつかの重要な動向が見られます。
第一に、バイオマーカーの発見と活用が急速に進んでいます。神経変性疾患は発症前の潜伏期間が長く、症状が顕在化した時点ではすでに不可逆的な神経細胞の損傷が広範囲に及んでいることが多いため、早期診断と治療介入が極めて重要です。脳脊髄液(CSF)や血液中の異常タンパク質(アミロイドβ、タウ、α-シヌクレインなど)、神経炎症マーカー、そしてPETやMRIなどの画像診断技術を用いた脳の変化の検出は、疾患の早期発見、病期分類、治療効果のモニタリングに不可欠なツールとなっています。特に、血液バイオマーカーの進歩は、より簡便で低侵襲な診断を可能にし、大規模なスクリーニングや臨床試験における患者層別化に貢献すると期待されています。
第二に、個別化医療の推進です。神経変性疾患は、同じ診断名であっても患者様ごとに病態の進行や治療反応性が異なることが認識されています。遺伝子解析技術の進歩により、特定の遺伝子変異を持つ患者様に対する標的治療薬の開発が可能となり、例えばSOD1変異ALSに対するトフェルセンはその代表例です。将来的には、患者様の遺伝子情報、バイオマーカープロファイル、臨床症状などを統合的に解析し、最適な治療法を選択するプレシジョン・メディシンが主流となるでしょう。
第三に、新規モダリティの導入が加速しています。従来の低分子化合物に加え、モノクローナル抗体、アンチセンスオリゴヌクレオチド(ASO)、siRNAなどの核酸医薬、そして遺伝子治療や細胞治療といった、より高度なバイオテクノロジーを用いた治療法が開発の最前線にあります。モノクローナル抗体は、特定の異常タンパク質を標的として除去・不活性化する能力に優れており、アルツハイマー病における抗アミロイドβ抗体はその成功例です。核酸医薬は、遺伝子レベルで病態に関わるタンパク質の産生を抑制したり、機能を修飾したりすることが可能であり、ALSやハンチントン病において有望な結果が報告されています。遺伝子治療は、神経保護因子を導入したり、異常遺伝子を編集したりすることで、根本的な治療を目指す究極のモダリティとして期待されていますが、安全性や送達効率の課題克服が求められています。
第四に、多因子病態へのアプローチです。神経変性疾患が単一のメカニズムではなく、複数の病態経路が複雑に絡み合って進行することが明らかになるにつれて、単一標的薬だけでなく、複数の経路に作用する薬剤や、異なる作用機序を持つ薬剤の併用療法が注目されています。例えば、異常タンパク質の凝集、神経炎症、ミトコンドリア機能不全、オートファジーの障害など、複数の病態を同時に改善する薬剤の開発や、既存薬のドラッグリポジショニング(既存薬の新たな効能を見出すこと)も積極的に行われています。
第五に、人工知能(AI)と機械学習(ML)の活用です。AI/ML技術は、膨大なデータの中から新たな創薬標的を特定したり、薬剤候補化合物を効率的に探索したり、臨床試験の設計を最適化したりする上で、その貢献が期待されています。特に、複雑な病態メカニズムの解明や、個別化医療における患者層別化、バイオマーカーの解析などにおいて、AI/MLは創薬プロセスを加速させる強力なツールとなりつつあります。
これらの動向は、神経変性疾患医薬品の開発が、従来の枠組みを超えて、より革新的かつ多角的なアプローチへと進化していることを示しています。
展望
神経変性疾患医薬品の未来は、依然として多くの課題を抱えつつも、かつてないほどの希望に満ちています。現在のところ、ほとんどの神経変性疾患には根本的な治療法が存在せず、進行を完全に止めることは困難ですが、近年の科学技術の進歩は、この状況を大きく変え得る可能性を秘めています。
最も重要な展望の一つは、疾患修飾薬のさらなる発展と普及です。アルツハイマー病における抗アミロイドβ抗体薬の登場は、疾患の進行そのものに介入し得る薬剤が実現可能であることを示しました。この成功は、他の神経変性疾患においても、それぞれの病態を駆動する主要な分子メカニズムを標的とした疾患修飾薬の開発を加速させるでしょう。アミロイドβ、タウ、α-シヌクレイン、ハンチンチンタンパク質など、異常タンパク質の凝集・蓄積を抑制する薬剤、神経炎症を制御する薬剤、ミトコンドリア機能を改善する薬剤、神経保護作用を持つ薬剤など、多様なアプローチが臨床試験段階にあり、今後数年で新たな治療選択肢が生まれる可能性が高まっています。
また、早期診断と早期介入の重要性がますます高まるでしょう。疾患が進行し、広範囲の神経細胞が不可逆的な損傷を受けた後では、治療効果が限定的になることが多いため、症状が現れる前の段階、あるいはごく初期の段階で疾患を検出し、治療を開始することが、より良い転帰をもたらすと考えられています。血液バイオマーカーや高感度な画像診断技術の進歩は、この早期診断の実現に不可欠であり、将来的には、リスクのある個人に対する予防的介入や、早期の疾患修飾療法が標準となるかもしれません。
個別化医療の実現も、今後の重要な展望です。遺伝子解析、バイオマーカープロファイリング、そしてAI/ML技術の統合により、患者様一人ひとりの疾患の特性や進行パターンを詳細に理解し、最も効果的な治療法をテーラーメイドで提供することが可能になるでしょう。これにより、治療効果の最大化と副作用のリスク低減が期待されます。特に、希少な遺伝性神経変性疾患においては、遺伝子治療やASOなどのモダリティが、特定の遺伝子変異を持つ患者様に対する画期的な治療法として確立される可能性があります。
さらに、学際的な協力体制の強化が不可欠です。神経科学、薬理学、遺伝学、画像診断学、そして情報科学といった多様な分野の研究者が連携し、基礎研究から臨床応用までを一貫して推進することで、複雑な神経変性疾患の病態解明と新たな治療法の開発が加速されるでしょう。製薬企業、アカデミア、政府機関、患者団体が一体となって取り組むことで、より効率的かつ倫理的な研究開発が可能となります。
しかしながら、新たな医薬品の開発には、依然として高いコストと長い期間がかかります。特に、疾患修飾薬は高額になる傾向があり、その普及と持続可能な医療提供体制の構築は、社会全体で取り組むべき課題となります。また、倫理的な問題、例えば遺伝子治療の安全性や、早期診断によって疾患リスクが判明した際の心理的負担などについても、慎重な議論と対応が求められます。
総じて、神経変性疾患医薬品の展望は、科学技術の進歩に支えられ、疾患の進行を遅らせ、あるいは停止させる可能性を秘めた新たな治療法の登場を予感させます。今後数十年の間に、これらの難病に対する理解が深まり、より効果的で安全な治療選択肢が提供されることで、多くの患者様とそのご家族の生活の質が大きく改善されることが期待されます。