世界の製薬規制業務市場の規模、シェア、成長予測、2025年 – 2032年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
製薬規制業務市場に関する市場調査報告書の概要は以下の通りです。
**市場の概要**
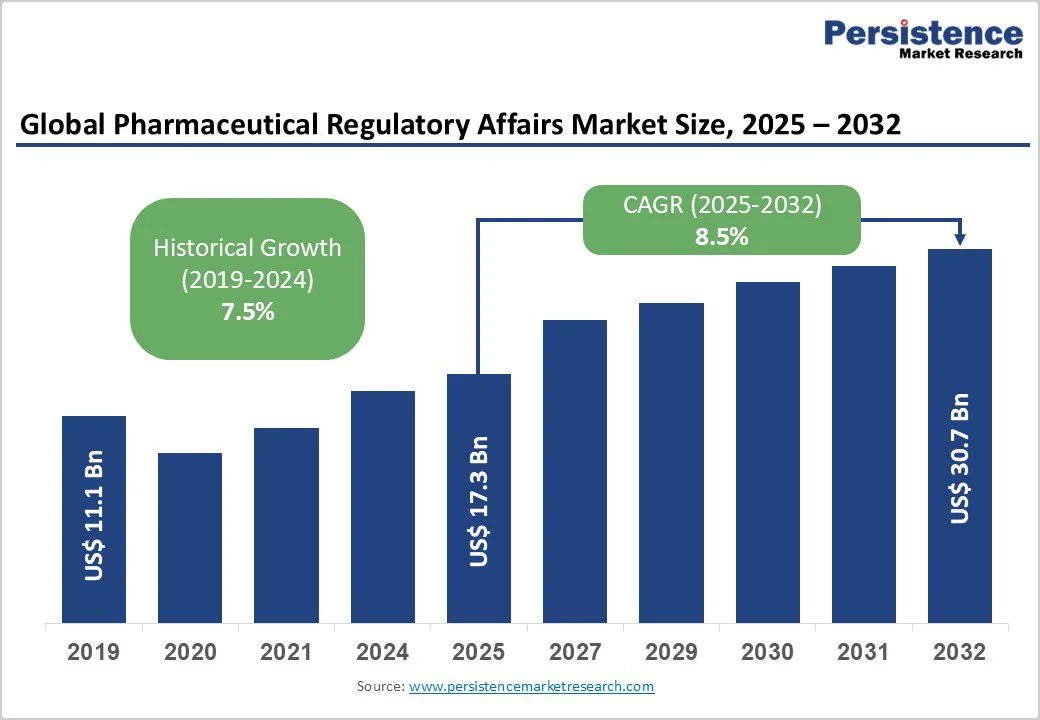
グローバルな製薬規制業務市場は、2025年に173億米ドルで評価され、2032年には307億米ドルに達する見込みであり、2025年から2032年にかけて年平均成長率(CAGR)は8.5%と予測されています。この成長は、医薬品承認のプロセスの複雑化、生物製剤および先進的治療医薬品(ATMP)の急速な拡大、主要市場における規制の調和努力によって推進されています。製薬およびバイオテクノロジー企業は、進化するコンプライアンス要求に対応するために規制機能を外注し、承認を加速させ、運営コストを削減する傾向が強まっています。
**市場の推進要因**
市場成長の主要因は、FDAのブレークスルー治療指定やEMAのPRIMEプログラムなどの革新によって、専門的な規制の専門知識へのニーズが高まっていることです。これにより、加速承認メカニズムの広範な採用が進み、医薬品開発の経済性やタイムラインが根本的に変化しています。例えば、2021年から2023年の間に、FDAは承認された医薬品の25%にブレークスルー治療指定を与えました。このような迅速な経路により、特に腫瘍学や希少疾患、遺伝子治療において、開発タイムラインが数ヶ月圧縮されています。
**市場の制約要因**
製薬規制業務における制約要因には、コンプライアンスコストの高騰や、法域間での規制の分断が含まれます。グローバルな製薬企業は、規制コンプライアンスに毎年数十億ドルを費やしており、重大なコンプライアンスの失敗は巨額の修正作業を引き起こします。小規模な製薬およびバイオテクノロジー企業は、規制コンプライアンスが運営予算の大部分を占めるため、特に影響を受けやすいです。このコスト負担は、革新的なスタートアップが新規治療薬を開発する際の参入障壁を強化しています。
**市場機会**
市場における最も有望な機会は、ATMPに対する専門的なサービスです。これには遺伝子治療、細胞治療、組織工学製品が含まれ、バイオシミラーセグメントも拡大しています。バイオシミラーの承認には、参照生物製剤との比較を示すための複雑な規制提出が必要であり、FDAの351(k)経路やEMAのバイオシミラーガイドラインを含む、バイオロジクス特有の経路を扱える規制専門家の需要が急増しています。
**セグメント分析**
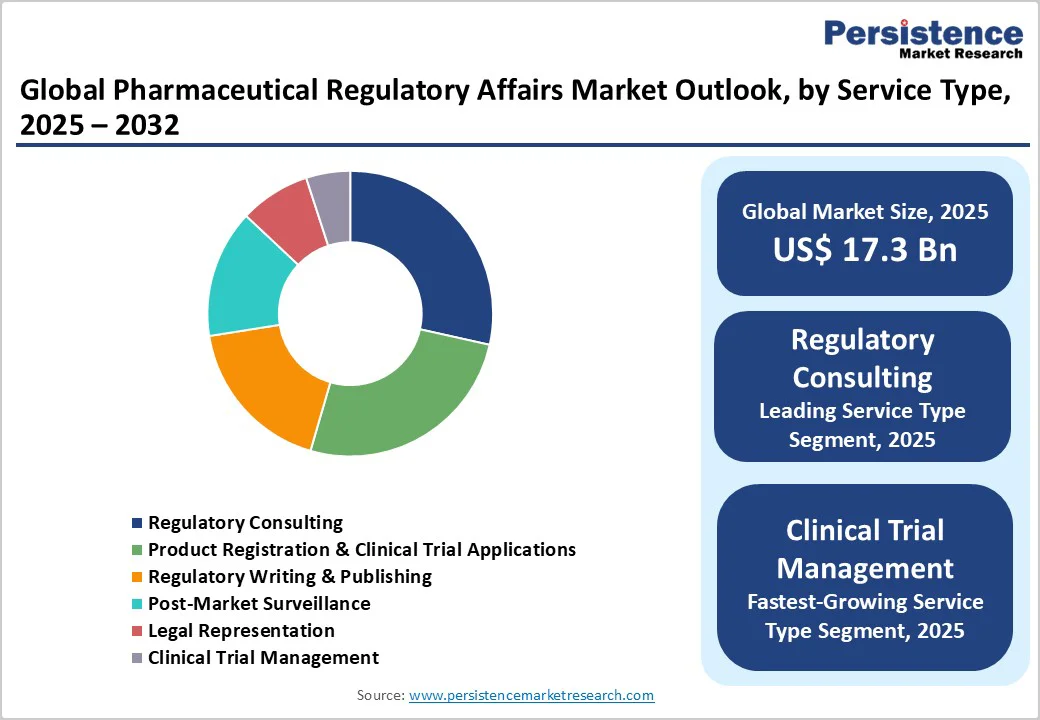
2025年には、規制コンサルティングが市場の約28.5%の収益シェアを占め、戦略的なガイダンスを必要とする製薬企業にとって高付加価値のアドバイザリーサービスを提供しています。このセグメントは、臨床試験管理サービスが2032年までで最も急成長しているセグメントであることからも明らかです。ATMPや遺伝子治療、個別化医療の複雑な臨床試験の proliferation により、開発ライフサイクル全体での規制の監視が求められています。
従来の製薬医薬品は、依然として最も大きな収益シェアを持ち、歴史的な支配力を維持しています。バイオロジクスは、2025年から2032年にかけて最も急成長する製品カテゴリーであり、大分子治療薬に対する製薬企業の関心の高まりが背景にあります。特にATMPは、従来の薬剤提出を遥かに超える専門的な規制知識が求められます。
**地域別市場の動向**
北米は2025年に33%の市場シェアを持つ第2位の市場であり、特に米国はFDAの厳格な規制フレームワークや医薬品R&Dへの高い投資により、イノベーションの中心となっています。ヨーロッパは、2024年に28のバイオシミラーを承認するなど、バイオシミラーリーダーとしての地位を強化しています。アジア太平洋地域は、最も高いCAGRを記録し、製薬規制業務の最大かつ最も急成長する地域市場です。
**競争環境**
製薬規制業務市場は中程度に分散しており、IQVIA、Parexel、ICONなどの主要なCROが約25%のシェアを占めています。中堅企業やニッチな企業も専門的なニーズに応じたサービスを提供していますが、競争は治療専門知識、地域能力、技術の採用によって駆動されています。
結論として、製薬規制業務市場は、複雑な医薬品承認プロセスの増加、生物製剤やATMPの急成長、主要市場での規制調和の努力によって牽引され、2025年から2032年にかけて8.5%のCAGRで成長することが予測されています。
Report Coverage & Structure
エグゼクティブサマリー
報告書のエグゼクティブサマリーでは、2025年と2032年におけるグローバルな製薬規制業務市場の概要が示されています。このセクションでは、市場の機会評価が示され、2025年から2032年までの予測がUS$億単位で行われています。また、市場の主要トレンドや将来の市場予測、プレミアム市場の洞察、製品開発の動向や主要な市場イベントに関する情報が提供され、PMR分析および推奨事項が述べられています。
市場概要
このセクションでは、製薬規制業務市場のスコープと定義が明確化され、市場のダイナミクスが詳細に分析されています。具体的には、市場を牽引するドライバー、制約要因、機会、そして主要トレンドが整理されています。さらに、マクロ経済的要因に関しては、グローバルなセクターの見通しやGDP成長の見通しが考察され、COVID-19の影響分析も行われています。
付加価値の洞察
この部分では、ツールの採用状況分析、規制環境、バリューチェーン分析、PESTLE分析、ポーターのファイブフォース分析が含まれ、製薬規制業務市場に関連する様々な要因が検討されています。これにより、市場の競争力や成長性に関する深い洞察が得られます。
価格分析(2024A)
価格分析セクションでは、2024年の価格の主要なハイライトが示され、展開コストに影響を与える重要な要因が明確にされます。さらに、サービスタイプ別の価格分析が行われ、どのサービスが市場で優位性を持つかの考察がなされるでしょう。
グローバル製薬規制業務市場の見通し
このセクションでは、市場のボリューム予測、US$億単位の市場規模の分析および年次成長率が示され、絶対的な機会も示されます。また、サービスタイプ別、製品別、開発段階別の市場規模とボリュームの分析が行われ、各セグメントの市場魅力が評価されます。
地域別の製薬規制業務市場の見通し
地域ごとの市場見通しでは、北米、ヨーロッパ、東アジア、南アジアおよびオセアニア、ラテンアメリカ、中東およびアフリカなど、主要な地域に分けて市場規模が分析されます。各地域について、歴史的な市場規模の分析と2025年から2032年までの予測が行われ、地域ごとの市場の魅力が分析されます。
北米製薬規制業務市場の見通し
北米市場の分析では、米国とカナダの市場規模が具体的に示され、サービスタイプや製品、開発段階別の詳細な予測が行われます。これにより、北米市場の動向と市場が抱える課題が明らかになります。
ヨーロッパ製薬規制業務市場の見通し
ヨーロッパ市場では、ドイツ、フランス、英国、イタリア、スペイン、ロシア、トルコなどの主要国の市場規模が分析されます。また、サービスタイプや製品、開発段階に基づく詳細な予測が行われ、地域特有の市場動向が明示されます。
東アジア製薬規制業務市場の見通し
このセクションでは、中国、日本、韓国の市場が取り上げられ、それぞれの国のサービスタイプや製品、開発段階別の市場規模が詳細に分析されます。
南アジアおよびオセアニア製薬規制業務市場の見通し
インド、東南アジア、オーストラリア・ニュージーランド(ANZ)など、南アジアおよびオセアニア地域の市場規模と成長が詳しく分析され、特にこの地域の特性に基づいた市場戦略が考察されます。
ラテンアメリカ製薬規制業務市場の見通し
ブラジル、メキシコなど、ラテンアメリカ地域の市場動向が詳細に分析され、サービスタイプや製品、開発段階に基づいた市場規模の予測が行われます。
中東およびアフリカ製薬規制業務市場の見通し
このセクションでは、GCC諸国、エジプト、南アフリカ、北アフリカの市場が分析され、各地域の製薬規制業務市場の成長要因や市場機会が検討されます。
競争環境
競争環境セクションでは、2024年の市場シェア分析や市場構造が示され、競争の激しさを示すマッピングが行われます。また、主要企業のプロファイルが詳細に記載され、企業の概要、財務状況、戦略、最近の開発に関する情報が提供されます。この部分では、IQVIA、Parexel、ICON、Labcorp、Syneos Healthなどの主要企業が取り上げられ、各社の市場内での位置づけが明確にされます。
*** 本調査レポートに関するお問い合わせ ***

製薬規制業務とは、医薬品の開発、製造、販売に関する法律や規則を遵守し、薬剤の安全性、有効性、品質を確保するための業務を指します。この業務は、製薬会社が新薬を市場に投入する際に必要不可欠なプロセスであり、各国の薬事法や国際的な基準に基づいて行われます。製薬規制業務は、製薬メーカーと規制当局との間の重要な架け橋となり、患者に安全かつ効果的な医薬品を提供するための重要な役割を果たしております。
製薬規制業務には、主に二つのタイプがあります。一つは、臨床試験に関する規制業務です。これは、新薬の安全性や有効性を評価するために実施される臨床試験が、倫理的かつ科学的に実施されることを保証するための業務です。もう一つは、市販後の監視業務です。これは、医薬品が市場に出た後も、その安全性や有効性を継続的に監視し、必要に応じて追加の情報提供や警告を行う業務です。
製薬規制業務は、さまざまな用途があります。例えば、医薬品の承認申請を行う際には、製薬企業は臨床試験の結果や製造プロセスの詳細を規制当局に提出する必要があります。また、市販後の監視業務では、医薬品に関する副作用の報告を収集し、分析することで、リスク管理を行うことが求められます。これにより、患者に対する医薬品のリスクを最小限に抑えることが可能となります。
さらに、製薬規制業務には、関連する技術も多く存在します。例えば、電子データ管理システムは、臨床試験データの収集や解析において重要な役割を果たしており、データの正確性と透明性を向上させる助けとなっています。また、リスク評価ツールや薬剤安全性評価システムなどは、市販後の監視業務においても活用されており、迅速かつ効果的な対応を可能にしています。
このように、製薬規制業務は医薬品の開発から市場投入、さらには使用後の監視に至るまで、多岐にわたる工程と技術が絡み合った複雑な業務です。患者の健康と安全を守るために、常に進化し続けるこの分野において、規制の遵守と技術の活用は、ますます重要な役割を果たすことが期待されます。製薬業界における規制業務の重要性は、今後もますます高まっていくことでしょう。