コンパニオン診断の世界市場(2025-2030):技術別、疾患別、製品種類別、検体種類別、エンドユーザー別、地域別

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
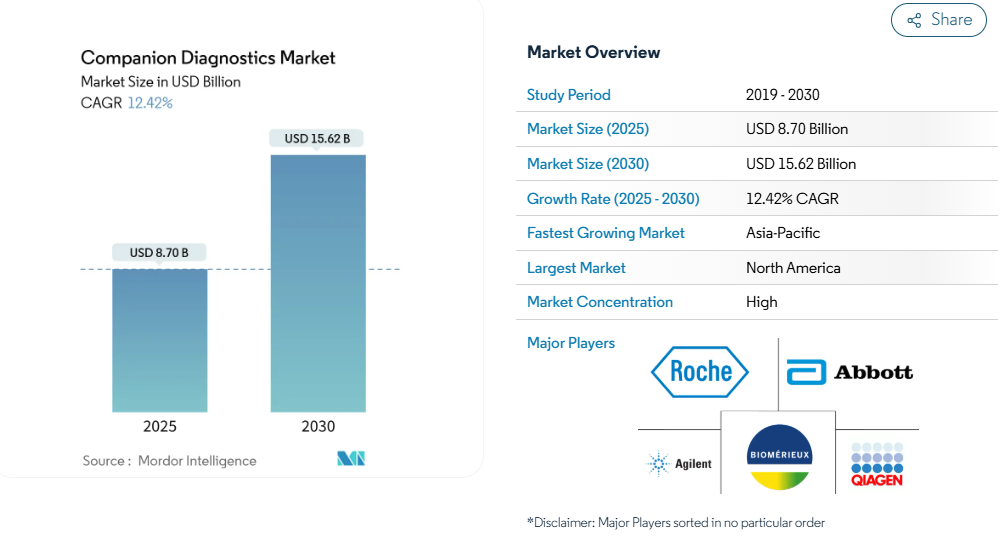
2025年の金額別市場規模は87億米ドルで、年平均成長率12.42%を反映し、2030年までに156.2億米ドルに拡大すると予測されています。
コンパニオン診断は、分子検査と標的治療薬を統合し、診断情報と最適な治療法の選択を一致させます。
精密医療の応用の拡大は、同時に医薬品メーカーの投資の優先順位をシフトさせ、政策立案者が診断薬を極めて重要なコスト抑制ツールとして認識することで、支払者の償還モデルを再構築しています。
レポートの要点
- 市場拡大の原動力は検査量の増加よりも分子ターゲットの多様化であり、幅広い検査メニューを持つ診断薬企業にとっては収益の倍増要因。
- 2024年の市場シェアは北米が40.4%を占めますが、支払者の保険適用決定は世界的に広がっており、既存市場と新興市場の間の償還ギャップを縮小しています。
- リキッドバイオプシーは年平均成長率18.9%で最も急成長している試料の種類であり、その採用により、がん診療施設は即日瀉血を中心とした患者フローモデルの再設計を促しています。
- CRO(医薬品開発業務受託機関)は、スポンサーがバイオマーカー戦略をアウトソーシングし、CROを分子共同戦略家として効果的に位置づけることで、下流の収益の大きな部分を獲得する方向にあります。
- 欧州連合(EU)の体外診断用医薬品規制(IVDR)は承認スケジュールを延長しており、その結果ボトルネックとなっているため、検査開発企業はヨーロッパよりも米国やアジア太平洋地域での上市を優先するようになり、従来の地理的な上市順序が変化しています。
コンパニオン診断薬市場の動向と洞察 腫瘍診療におけるリキッドバイオプシーCDxの急速な普及
リキッドバイオプシーコンパニオン診断薬は、腫瘍の不均一性をリアルタイムでとらえ、低侵襲で繰り返し検査できるルートを提供することで、がん管理を再定義しています。臨床医は現在、循環する腫瘍DNAを通して疾患の進化を追跡し、静的な組織スナップショットに依存するのではなく、動的に治療を調整しています。二次的な影響として、病院の検査室は、より大量の血液ベースのアッセイに対応するために、スループットとコールドチェーンロジスティクスを再調整する必要があり、腫瘍学サービスライン全体の資本割り当てスケジュールに影響を与えます。2024年に複数のFDA承認を取得したFoundationOne Liquid CDxは、市場導入を加速している規制の勢いを示しています[1]。しかし、リキッドバイオプシーの感度は癌の病期や腫瘍の排出生物学によって異なるため、医療機関は検査の冗長性を抑えつつ診断精度を維持する組織と血液のハイブリッド戦略を採用する必要に迫られています。
個別化医薬品とプレシジョン・オンコロジーの進歩
コンパニオン診断薬は、オプションのアドオンの域を超え、多くの標的薬剤を利用するための必須条件として体系化されました。FDAは、承認された検査に関連する168のバイオマーカーと薬剤のペアをリストアップし、分子学的確認が不十分な治療コースに対する支払いを償還機関が段階的に差し控えることを示唆しています。この関連性により、製薬会社は第I相試験の早い段階で検査を共同開発する方向に舵を切っており、プログラム全体のスケジュールは短縮されていますが、前臨床の複雑さは増しています。CRO(医薬品開発業務受託機関)は、バイオマーカー検証ベンチを拡大し、複数年の戦略的アウトソーシング契約を確保することで、バイオ医薬品パイプラインの事実上の分子ゲートキーパーとしての地位を確立しています。
診断ツールの技術革新
次世代シーケンサー(NGS)は、単一のワークフローで包括的なゲノムの洞察を提供し、そのセグメントは2025年から2030年の間に14.3%成長すると予測されています。検査室はNGSの出力に人工知能アルゴリズムを重ね、氾濫するバリアントをトリアージしていますが、これは診断の労働需要をウェットラボの技術者からデータサイエンティストへと微妙にシフトさせる動きです。バイオインフォマティクスの求人数の増加から推測されるこの労働力のバランス調整は、大学のカリキュラムや自動アノテーションエンジンを提供するベンチャー企業に影響を与えています。肺がんNGSパネルが患者の最大65%で実用的な変異を同定することを考えると、支払者はすでに臨床的に実用的な所見の数に連動する可変の償還段階を立案しており、診断薬の価値ベースの価格設定モデルを予見しています。
慢性疾患の増加
がんの罹患率は上昇を続けており、米国がん協会は2024年の米国における新規罹患者数を約200万人と予測しています [2] 。がん罹患数の急増により、腫瘍センターは患者選別プロトコルの再設計を余儀なくされ、診断の所要時間が治療までの時間、ひいては品質評価による報酬に直接影響することを認識しています。製薬スポンサーは、コンパニオン診断薬を早期に組み入れることにより、統計的ノイズを減らし、臨床試験のパワーを高めることに対応しています。このような動きは、機関審査委員会にインフォームド・コンセントの文言を更新するよう促しています。分子プロファイリングが治療の適格性を決定することを患者が認めなければならなくなったからです。
高い開発コスト
コンパニオン診断薬の開発には、5,000万ドルから1億ドル、3年から5年の期間が必要とされ、診断薬は長いサイクルの資本プロジェクトとなります。中小企業は、大手製薬企業とのアライアンスに運命を託し、開発資金を得るために資本参加することが増えています。大企業がデバイスの権利を吸収するにつれて、新規参入企業の営業活動の自由度は狭まります。このような知的財産の逼迫は、ベンチャー投資家を、単一マーカーのコンセプトよりも、拡張性のあるアッセイメニューを持つプラットフォーム企業に誘導し、ニッチなバイオマーカーから拡張性のあるインフォマティクス主導のソリューションへとベンチャー資金を微妙に移行させています。
厳しい規制政策
欧州連合(EU)の体外診断用医薬品規則(IVDR)は、2022年にコンパニオン診断薬について、ノーティファイドボディと欧州医薬品庁の協議の義務化を導入しました[3]。完全に指定された機関はほんの一握りであるため、審査の待ち時間は長くなり、企業はまず米国または日本に発売の順序を振り向けざるを得なくなっています。その波及効果として、欧州のがん専門医は新規検査へのアクセスが遅れ、がん治療における地理的公平性に関する倫理的議論が提起される可能性があります。米国では、FDAが試験的に実施した検査の性能特性の公開が透明性を高めると同時に、性能の低い検査が露呈し、診断薬企業の風評リスクが高まり、買い手の監視の目が厳しくなっています。
セグメント分析
セグメント分析技術: NGSが従来型の検査パラダイムを破壊
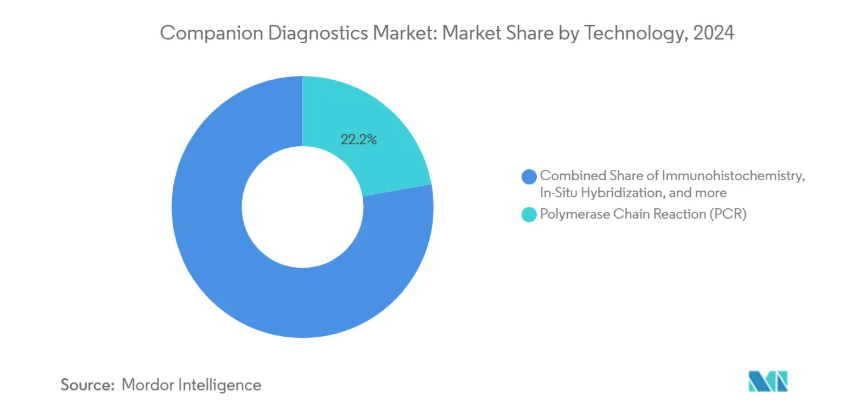
2024年の市場シェアは依然としてPCRが22.2%で最大ですが、NGSは他の技術を凌駕すると予想されます。コンパニオン診断におけるNGS市場規模は、PCRベースの代替技術を凌駕し、2025年から2030年にかけて年平均成長率14.3%で拡大すると予測。病院の調達委員会は、高いサンプルスループットが3年間の償却期間中に高いNGS消耗品コストを相殺することを明らかにするTotal Cost of Ownership分析を実施するようになっています。その結果、装置ベンダーは試薬契約に分析ソフトウェアをバンドルするようになり、この契約により収益認識が1回限りのハードウェア販売から定期的なサービスの流れに移行し、四半期収益の可視性が向上しています。
疾患別: メラノーマが成長フロンティアとして浮上
メラノーマのコンパニオン診断薬は、免疫療法との併用が増加するにつれて、2030年までのCAGRが13.6%に加速し、市場シェアを獲得する見込みです。下流への影響としては、皮膚科クリニックは迅速な反射テストを確実に行うために分子ラボと緊密に連携する必要があり、歴史的に別々であった2つの臨床サイロを効果的に融合させることが挙げられます。このような統合により、電子カルテベンダーはオーダーエントリーモジュールをレフレックス分子パネルに対応させる必要があります。
製品とサービス ソフトウェア・ソリューションが成長を加速
アッセイとキットは2024年の支出の66.3%を占めます。しかし、ソフトウェア主導の解釈プラットフォームは、CAGR 15.8%(2025-2030年)で最も急成長している製品カテゴリーです。診断精度は、機械学習による継続的なアップデートの対象となる変種分類パイプラインにかかっており、規制当局は市販後のアルゴリズム変更規制を検討しています。臨床判定を大幅に改善する可能性のあるソフトウェアのアップグレードを拒否した場合、検査施設は法的責任を負う可能性があり、検査施設の認定審査にソフトウェア・メンテナンス条項が暗黙のうちに盛り込まれることになります。
検体の種類: リキッドバイオプシーによる検査パラダイムの変革
組織生検は依然として規制上のゴールドスタンダードであるため、2024年の市場規模の78.5%を占めています。リキッドバイオプシーの市場規模は2030年まで年平均成長率18.9%で拡大すると予測。腫瘍科診療所では、この急増に対応するため、すでに瀉血スタッフの配置換えが行われており、ポイントオブケア血液処理装置の需要が微妙に増加しています。これまで組織病理学に特化していた検査室は、血漿-DNA抽出システムに投資しなければならなくなり、資本予算サイクルに影響を与える運営費の緊張が生まれます。
エンドユーザー CROが戦略的パートナーとして台頭
CROのコンパニオン診断薬市場規模は年平均成長率13.2%(2025-2030年)で上昇する見込みです。CROのバイオマーカー検証の幅広い経験により、中小のバイオテクノロジー企業は、通常であれば困難な薬事規制へのアクセスが可能になります。このような位置づけにより、CRO は試験のマイルストーンに連動したリスク分担手数料モデルを交渉することが可能となり、サービスベンダーから準開発パートナーへとシフトすることができます。
地域別分析
2024年の市場シェアは北米が40.4%。UnitedHealthcareは、FDAが承認したコンパニオン診断薬と対応する医薬品を併用する場合、その医薬品をカバーする方針を示しています。推測される結果は、UnitedHealthcare傘下以外の民間保険会社が競争力を維持するためにこの方針を模倣し、業界全体の検査償還率を安定させるカスケードへとつながる可能性があるということです。[4]
アジア太平洋地域は、2025年から2030年にかけて年平均成長率12.7%を記録すると予測されています。日本の政府支援によるがんゲノムプロファイリング(CGP)プログラムは、2035年までに540億円のCGP市場を予測し、国内の研究所にシーケンス能力の拡大を促しています。この政府のコミットメントは、近隣諸国が複製し、規制当局の期待を調和させ、国境を越えた臨床試験登録に拍車をかけ、研究が不十分なアジアの集団におけるデータ蓄積を加速させる可能性のある先例を示しています。
ヨーロッパの体外診断薬規制環境は、企業に上市戦略の再検討を促しています。ノーティファイド機関のキャパシティが限られているため、市場投入までの時間的リスクが増大し、診断薬企業は暫定的な解決策として集中試験モデルを検討することになります。このような一元化は、不注意にも一部の基準検査機関を強化し、検査量がピークに達した時点で価格決定力を左右する準独占状態を生み出す可能性があります。
競争環境
競争環境は、ロシュのような多角的プレイヤーとガーダント・ヘルス社のような機敏なスペシャリストが混在しています。戦略的共同開発契約は依然として極めて重要です: ロシュの200を超える製薬企業との提携ポートフォリオは、多くの臨床試験プロトコールに診断薬を組み込んでおり、上市時にほぼ自動的に取り込まれることを保証しています。実世界の大規模なゲノムデータセットを管理する企業は、より迅速に予測アルゴリズムを改良することができ、試薬のみの競合他社には真似のできない反復的な優位性を得ることができます。
最近の産業動向
- 2025年1月 ロシュ、抗HER2/neu抗体PATHWAYのFDAによる適応拡大承認を取得。
- 2024年12月 アジレントのPD-L1 IHC 28-8 pharmDxがEU IVDR認証を取得
- 2024年11月 ロシュがVENTANA FOLR1 RxDxアッセイのCEマークを取得
コンパニオン診断薬産業レポートの目次
1. はじめに
1.1 前提条件と市場定義
1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
4.1 市場概要
4.2 市場促進要因
4.2.1 腫瘍診療におけるリキッドバイオプシーCDxの急速な採用
4.2.2 個別化医薬品とプレシジョン・オンコロジーの進歩
4.2.3 診断ツールの技術革新
4.2.4 慢性疾患の有病率の増加
4.2.5 マルチプレックスCDxプラットフォームを必要とするADCに焦点を当てたがん領域のパイプライン
4.2.6 製薬企業からの投資の増加
4.3 市場の阻害要因
4.3.1 高い開発コスト
4.3.2 FDAの市販後エビデンス義務によるライフサイクルコストの上昇
4.3.3 厳しい規制政策
4.3.4 新興国におけるインフラの制限
4.4 サプライチェーン分析
4.5 規制の見通し
4.6 ポーターのファイブフォース分析
4.6.1 新規参入の脅威
4.6.2 買い手の交渉力
4.6.3 供給者の交渉力
4.6.4 代替品の脅威
4.6.5 競争上のライバル関係
5. 市場規模・成長予測(金額別)
5.1 技術別
5.1.1 免疫組織化学(IHC)
5.1.2 ポリメラーゼ連鎖反応(PCR)
5.1.3 リアルタイムPCR(RT-PCR)
5.1.4 インサイチュハイブリダイゼーション(ISH)
5.1.5 次世代/遺伝子シーケンス(NGS)
5.1.6 その他の技術
5.2 疾患別
5.2.1 肺がん
5.2.2 乳がん
5.2.3 大腸がん
5.2.4 白血病
5.2.5 黒色腫
5.2.6 胃がん
5.2.7 前立腺がん
5.2.8 その他の疾患別
5.3 製品・サービス別
5.3.1 アッセイ&キット
5.3.2 機器・分析装置
5.3.3 ソフトウェア・ア・サービス(SaaS
5.4 検体種類別
5.4.1 ティッシュバイオプシー
5.4.2 リキッドバイオプシー
5.4.3 細胞診スメア
5.5 エンドユーザー別
5.5.1 製薬・バイオテクノロジー企業
5.5.2 CRO(医薬品開発業務受託機関)
5.5.3 臨床リファレンス研究所
5.5.4 病院・がんセンター
5.6 地域別
5.6.1 南米アメリカ
5.6.1.1 米国
5.6.1.2 カナダ
5.6.1.3 メキシコ
5.6.2 ヨーロッパ
5.6.2.1 ドイツ
5.6.2.2 イギリス
5.6.2.3 フランス
5.6.2.4 イタリア
5.6.2.5 スペイン
5.6.2.6 その他のヨーロッパ
5.6.3 アジア太平洋
5.6.3.1 中国
5.6.3.2 日本
5.6.3.3 インド
5.6.3.4 韓国
5.6.3.5 オーストラリア
5.6.3.6 その他のアジア太平洋地域
5.6.4 中東
5.6.4.1 GCC
5.6.4.2 南アフリカ
5.6.4.3 その他の中東地域
5.6.5 南米アメリカ
5.6.5.1 ブラジル
5.6.5.2 アルゼンチン
5.6.5.3 その他の南米アメリカ
6. 競争環境
6.1 市場集中
6.2 戦略的な動き
6.3 市場シェア分析
6.4 企業プロフィール(グローバルレベルの概要、市場レベルの概要、コアセグメント、財務情報(可能な限り)、戦略情報、市場ランク/シェア、製品・サービス、最近の動向を含む
6.4.1 Abbott
6.4.2 Agilent Technologies Inc.
6.4.3 F. Hoffmann-La Roche Ltd
6.4.4 bioMérieux SA
6.4.5 QIAGEN N.V.
6.4.6 Siemens Healthineers AG
6.4.7 Thermo Fisher Scientific Inc.
6.4.8 Danaher Corp. (Beckman Coulter)
6.4.9 Illumina Inc.
6.4.10 Myriad Genetics Inc.
6.4.11 Guardant Health Inc.
6.4.12 Sysmex Corp.
6.4.13 Abnova Corp.
6.4.14 Biogenex Laboratories Inc.
6.4.15 Tempus Labs Inc.
6.4.16 Foundation Medicine Inc.
6.4.17 Exact Sciences Corp.
6.4.18 PerkinElmer Inc.
6.4.19 Invivoscribe Inc.
7. 市場機会と将来展望
7.1 ホワイトスペースとアンメットニーズ評価
*** 本調査レポートに関するお問い合わせ ***
