がん治療の世界市場(2025-2030):治療法種類別、がん種類別、投与経路別、エンドユーザー別、地域別

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
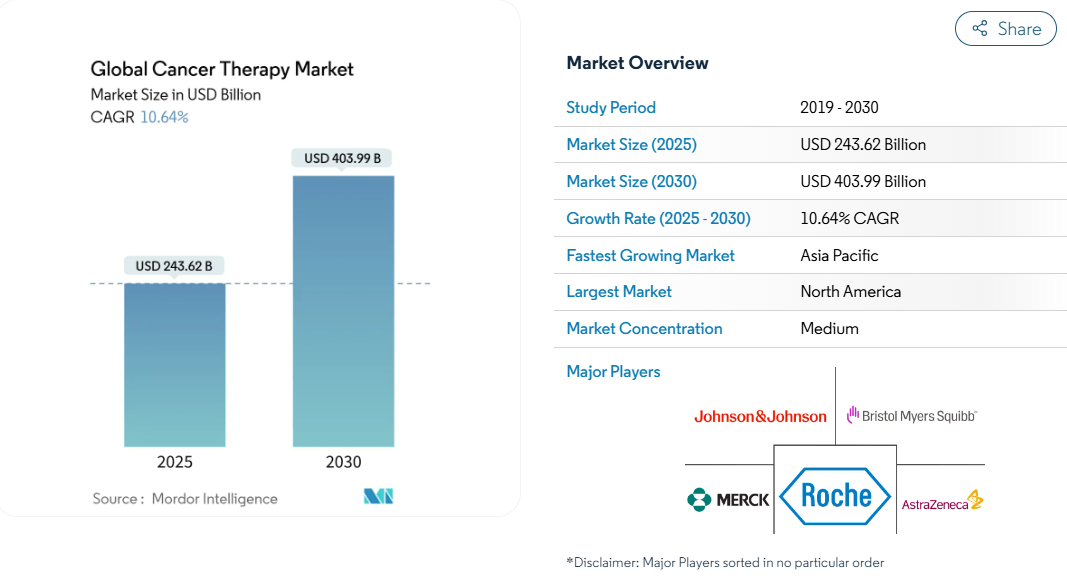
がん治療市場は、2025年に2,436億2,000万米ドルとなり、2030年には4,039億9,000万米ドルに拡大すると予測されています。
ゲノム・プロファイリングの進展、腫瘍診断認可の迅速化、細胞・遺伝子治療パイプラインの拡大が、がん治療市場を2桁成長へと押し上げています。
大手製薬会社はバイオマーカーを重視したポートフォリオを優先しており、アジアの医療投資は革新的なレジメンの地域導入を加速させています。
また、規制当局も柔軟性を増しており、実臨床でのエビデンスが承認までの期間を短縮できるようになっています。こうした好機にもかかわらず、がん治療市場はウイルスベクターのサプライチェーン上の限界と、持続的な金銭的毒性に直面しており、いずれも当面の普及率を押し下げる可能性があります。
レポートの要点
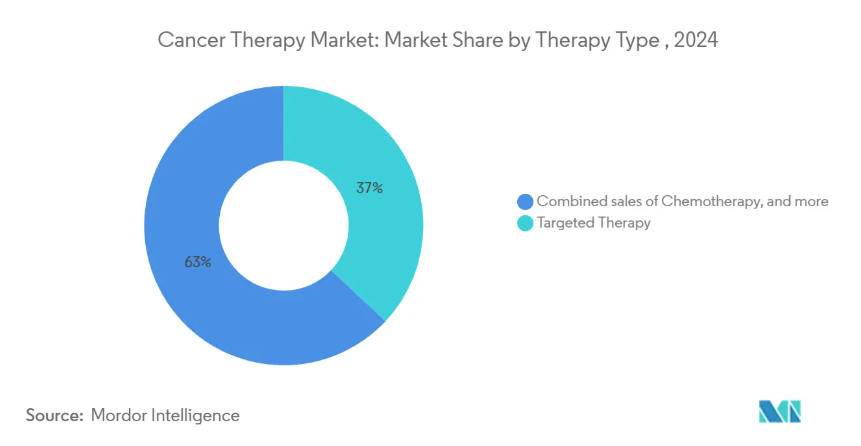
- 治療の種類別では、標的治療が2024年のがん治療市場シェア37.0%でトップ、細胞・遺伝子治療は2030年までCAGR 12.5%で拡大予測
- がんの種類別では、乳がんが2024年のがん治療市場規模の18.2%を占め、呼吸器/肺がんは2025〜2030年にCAGR 11.1%で成長すると予測。
- 投与経路別では、静脈内投与が2024年のがん治療市場規模の55.1%を占め、腫瘍内投与は2030年までの年平均成長率(CAGR)12.7%で上昇する見込み。
- エンドユーザー別では、病院が2024年にがん治療市場シェアの62.4%を占める一方、在宅医療環境は2030年までCAGR 11.7%を記録すると予測されています。
- 地域別では、北米が2024年にがん治療市場の43.0%を占め、アジア太平洋地域が2025〜2030年のCAGRが11.2%と最も高くなると予測。
腫瘍診断およびバイオマーカー主導型療法
2024年までに、fam-trastuzumab deruxtecan-nxki、repotrectinib[1]など、8つの腫瘍診断薬が承認される予定です。実際のデータでは21.5%の患者が潜在的な候補であり、がん治療市場は拡大し、適応試験デザインは奨励されています。医薬品企業は現在、このようなプレシジョン・メディシンの道筋に沿うため、また後期段階での減少リスクを軽減するために、コンパニオン診断薬を開発初期段階で優先しています。このアプローチはまた、対応可能な患者プールをさらに拡大する可能性のある、腫瘍をまたがる併用療法を促進します。
パイプラインの成長を加速する細胞・遺伝子治療
細胞・遺伝子治療への投資は2024年に30%増の152億ドルに急増。2,000以上の臨床試験と3,000以上の開発者が、この治療法の勢いを裏付けています。2024年2月に承認されたlifileucel(Amtagvi)は、固形がんに対する初の腫瘍浸潤性リンパ球療法で、31.5%の客観的奏効を達成。現在、大手製薬企業15社のうち13社がCGT専門部門を有しており、この破壊的プラットフォームに対する長期的なコミットメントを反映しています。
実際のエビデンスが地域アクセスを迅速化
日本の医薬品医療機器総合機構と中国の国家医薬品監督管理局は、がん領域の追加申請をサポートするリアルワールドエビデンスの受け入れを拡大しており、従来型と比較して審査時間を20~30%短縮しています[2]。汎アジア適応ESMOガイドラインは、分子検査要件の調和を図り、アジア全域における既存の治療格差を緩和する可能性があります。この規制の実用主義は、現地の技術革新を後押しするだけでなく、東南アジアの新興市場のための参照枠組みを作成します。
コンパニオン診断薬は精度とスピードを向上
FDAは、コンパニオン診断薬(CDx)がなければ安全性に重大な懸念が生じる可能性がある場合、CDxは必須であることを強調しています[3]。CDxの共同開発を加速することで、一般的な医薬品と診断薬の承認ギャップは18ヶ月から6ヶ月未満に短縮されます。ファイザーの血友病B遺伝子治療をサポートするラボコープのnAbCyteアッセイは、ファースト・イン・クラスのアッセイに対する規制当局の積極的な姿勢を浮き彫りにしました。しかしながら、2020年から2024年にかけて、10の標的薬がCDxを伴わないまま承認されており、このことは現在もアライメントギャップが続いていることを示しています。
深刻化する経済的毒性
がん患者の75%が自己負担額の補助を求めており、42.0%が深刻な経済的負担を訴えています。白血病では、移植適格患者の75.0%が、治療を遅らせたり中止したりする苦痛を経験しています。家計規模の大きい若年成人は不釣り合いに影響を受け、しばしば服薬アドヒアランスを低下させます。体系的な経済的苦痛のスクリーニングを行っている医療システムはほとんどなく、高コストのレジメンが標準治療になるにつれ、アクセスを保護するための政策的介入の余地が残されています。
製造能力のボトルネック
FDAが承認した8つのウイルスベクター遺伝子治療薬と145の開発後期候補薬が、既存の製造インフラに負担をかけています。非標準化された上流工程と労働集約的な精製工程が、特にベクター量を必要とする固形腫瘍細胞療法のスケールアップを妨げています。スポンサー各社は現在、収率を向上させるためにモジュラー設備や強化型バイオリアクターを模索していますが、2028年までに生産能力を大幅に増強できる見込みはなく、がん治療市場の短期的な拡大は緩やかなものになるでしょう。
セグメント分析
治療の種類別: 標的治療薬がリーダーシップを維持
標的療法は、特定の分子ドライバーを阻害する薬剤に対する臨床医の強い信頼を反映して、2024年のがん治療市場の37.0%を占めます。抗体薬物複合体とチロシンキナーゼ阻害剤が適応拡大を続ける一方で、2017年以降に承認された8つの腫瘍診断薬がこの優位性を支えています。免疫療法は、ライフロイセルやCAR-Tの改良などの画期的な進歩に支えられ、最も急速に成長している分野です。これとは対照的に、化学療法の役割は精密レジメンにおける併用療法へとシフトしており、分子誘導治療への進化をさらに強めています。
免疫療法のがん治療市場規模は、2024年の580億米ドルから2030年には1,200億米ドルに拡大すると予測され、年平均成長率は14.9%。売上高はチェックポイント阻害薬がリードしていますが、次世代二重特異性抗体がさらなる成長をもたらしています。PD-1/L1の臨床試験が500件以上進行中であり、競争は激しい。各社は、新規ターゲット(TIGIT、LAG-3など)や皮下投与製剤によるブランドライフサイクルの延長で差別化。
癌の種類別: 乳がん治療が引き続きネクサス
乳がん治療薬は、2024年のがん治療市場規模の18.2%を占め、臨床革新の旗手としての地位を確固たるものにしています。アジアは世界の乳がん罹患率の半分近くを占めており、ホルモン受容体陽性のサブタイプに関する地域特異的な臨床試験を後押ししています。CAR-T抗体や二重特異性抗体に後押しされ、血液がんがこれに続きます。2025年3月にFDAが承認したオベカブタジン・オートロイセルは、難治性B細胞性ALLにおいて63%の完全寛解率を達成し、細胞治療の変革の可能性を示しています。
肺がんでは、ALK、EGFR、ROS1検査陽性率が第一選択となり、経験的化学療法からジェノタイピングを併用したレジメンへの移行が着実に進んでいます。腫瘍変異負荷とKRAS G12Cターゲティングは、プレシジョン・オンコロジー・ツールキットの幅をさらに広げ、がん治療市場のこの高インシデンス・セグメントにおける需要の伸びを維持しています。
投与経路別: 利便性が台頭
点滴療法は、輸液センター網の定着とモノクローナル抗体のパイプラインの充実により、2024年にはがん治療市場の55.1%を維持。2024年12月に承認されたニボルマブの皮下投与は、静脈内投与に対する非劣性が証明され、チェアタイムが短縮され、注入反応が減少しました。他のチェックポイント阻害剤についても同様の移行が予想され、2030年までに静脈内投与のシェアが450bp低下する可能性があります。
腫瘍内注射は、腫瘍溶解性ウイルスや局所免疫療法のために出現しつつあります。前臨床データでは、全身投与に比べ腫瘍内薬物濃度が2〜3倍高いことが示されており、スポンサーはデポ製剤の試験に意欲を燃やしています。経口低分子製剤は、特に慢性的なレジメンには依然として有効ですが、大型生物学的製剤のバイオアベイラビリティの課題により、その成長は制約されています。
エンドユーザー別:専門的な設定が増加
総合的な輸液機能と集学的治療チームへのアクセスにより、2024年のがん治療市場シェアの62.4%を病院が占めました。腫瘍浸潤性リンパ球療法の登場により、バイオセーフティレベルのプロセッシング・スイートが必要となり、大規模施設の優位性が強化されています。しかし、最も急成長を記録したのは専門クリニックです。これらのクリニックは、無駄のない運営モデルを活用して標準化された輸液サービスを提供し、コスト抑制を求める容器にアピールしています。
アジアではハブ・アンド・スポークの枠組みが拡大しており、3次医療機関がサテライト・クリニックを訓練し、現地でメンテナンス・サイクルを管理するようになっています。このアプローチは、移動の負担を軽減し、腫瘍学サービスを分散化するという医療システムの目標に沿うものです。デジタル・ケア・コーディネーション・プラットフォームは遠隔での毒性管理を支援し、都市部の主要病院以外での複雑なレジメンの安全な展開をサポートします。
地域分析
北米は2024年のがん治療市場の43.0%を占め、深い臨床試験パイプラインと幅広い保険適用に支えられています。米国はファースト・イン・クラスの承認でリードしており、2024年中にFDAが承認したがん治療薬は29件にのぼります。それでも患者の自己負担額は世帯収入の20%を超えることが多く、金額ベースの価格設定に関する社会的な議論が高まっています。
アジアは最も急成長している地域で、がん治療市場は2030年までに年平均成長率11.2%を記録すると予想されています。中国のがん研究生産高は現在、米国を上回っています。優先審査バウチャーや集中調達改革などの政府のインセンティブは、価格インフレを抑えつつ、地域の技術革新を加速させることを目的としています。東南アジアでは、2050年までに年間203万人の新規症例が発生すると予測されており、スクリーニング・プログラムや幅広い分子検査へのアクセスが急務となっています。
ヨーロッパは、国民皆保険制度と共同研究ネットワークに支えられ、がん治療産業で大きなシェアを維持しています。欧州医薬品庁は最近、CDx評価に関する統一ガイダンスを発表し、精密医療の展開を促進しています。一方、中東、アフリカ、南米アメリカは新興クラスターです。これらの市場は、技術移転パートナーシップに投資して生物製剤の現地生産を促進し、手頃な価格と供給の弾力性を高めています。
がん治療市場は競争が激しく、ロシュ、ブリストル・マイヤーズ・スクイブ、アストラゼネカ、ノバルティスがそれぞれ数十億ドル規模のがん治療フランチャイズを有しています。ポートフォリオの幅の広さとコンパニオン診断薬の統合により、各社のスケールメリットが強化されています。例えば、アストラゼネカは2024年に抗体薬物複合体の新興企業を買収し、固形腫瘍のパイプラインを拡大しました。
抗体薬物複合体、二重特異性抗体、放射性リガンド治療薬では、専門バイオテクノロジー企業は破壊的な力を発揮し、しばしば大手の同業他社を凌駕しています。これらの治療法の5年間の年平均成長率は40〜48%に達し、がん治療市場全体の成長をはるかに上回っています。競争上の位置づけは、製造の俊敏性によって差別化されつつあり、特にウイルスベクターの生産能力では、早期参入企業が重要な供給上の優位性を確保しています。
人工知能(AI)プラットフォームは現在、標的同定と治験実施施設の最適化を支え、発見までの期間を短縮しています。AI企業と中堅製薬会社のパートナーシップは、データ主導の資産創出へのシフトを示しています。今後10年間で、AIをウェットラボでの検証やグローバルな製造ネットワークと統合できる企業が、がん治療市場でシェアを拡大する可能性があります。
最近の産業動向
- 2025年4月 2025年4月:アケソが進行性上咽頭がん治療薬penpulimab-kcqxのFDA承認を取得。
- 2024年11月 オートラス・セラピューティクス社が、再発または難治性のB細胞性急性リンパ芽球性白血病を対象としたAucatzyl(obecabtagene autoleucel)のFDA承認取得。
- 2025年3月 FDAが食道がんに対するtislelizumab-jsgr(Tevimbra)を承認、全生存期間中央値16.8カ月を報告。
- 2025年3月 ペムブロリズマブ(キイトルーダ)がHER2陽性胃がんの適応を追加、登録試験での全生存期間中央値は20.1カ月。
- 2025年3月 カボザンチニブ(カボメティクス)が神経内分泌腫瘍で承認取得、無増悪生存期間中央値13.8カ月を達成。
- 2024年4月 Ciltacabtagene autoleucel(cilta-cel)が多発性骨髄腫の前治療薬として承認を取得。
- 2024年12月 ニボルマブ皮下注製剤(オプジーボQvantig)が、これまでに承認されたすべての成人固形がんの適応症において、皮下注製剤として初めてPD-1阻害薬として使用可能となり、静脈内投与と比較して非劣性の薬物動態を記録。
世界のがん治療産業レポート目次
1. はじめに
1.1 前提条件と市場定義
1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
4.1 市場概要
4.2 市場促進要因
4.2.1 加速する腫瘍診断・バイオマーカー主導型治療の採用
4.2.2 世界で2,000件を超える細胞・遺伝子治療パイプラインの拡大
4.2.3 日本と中国における早期承認取得に向けた実臨床エビデンスのユーティリティの高まり
4.2.4 コンパニオン診断薬共同上市の急増による標的薬の市場投入期間の短縮
4.2.5 アメリカにおけるがん治療薬のバンドルモデルの普及
4.2.6 アジア太平洋地域における開発・製造受託の拡大がコスト効率に優れた生産を促進
4.3 市場阻害要因
4.3.1 治療放棄につながる金銭的毒性の高まり
4.3.2 細胞治療の供給を制限するウイルス・ベクターの製造能力のボトルネック
4.3.3 市場参入を遅らせるHTA金額別評価基準の相違
4.3.4 固形がんにおける長期有効性を損なう免疫療法耐性メカニズム
4.4 規制上の展望
4.5 技術的展望
4.6 ポーターのファイブフォース分析
4.6.1 新規参入の脅威
4.6.2 買い手の交渉力
4.6.3 供給者の交渉力
4.6.4 代替製品の脅威
4.6.5 競争ライバルの激しさ
5. 市場規模・成長予測(金額別)
5.1 治療の種類別
5.1.1 化学療法
5.1.2 標的療法
5.1.3 免疫療法
5.1.4 ホルモン療法
5.1.5 その他の治療種類
5.2 癌の種類別
5.2.1 血液がん
5.2.2 乳がん
5.2.3 前立腺がん
5.2.4 消化器がん
5.2.5 婦人科がん
5.2.6 呼吸器/肺がん
5.2.7 その他のがんの種類
5.3 投与経路別
5.3.1 静脈注射
5.3.2 経口
5.3.3 皮下
5.3.4 腫瘍内
5.4 エンドユーザー別
5.4.1 病院
5.4.2 専門クリニック
5.4.3 がん・放射線治療センター
5.4.4 在宅医療
5.5 地域別
5.5.1 南米アメリカ
5.5.1.1 米国
5.5.1.2 カナダ
5.5.1.3 メキシコ
5.5.2 ヨーロッパ
5.5.2.1 ドイツ
5.5.2.2 イギリス
5.5.2.3 フランス
5.5.2.4 イタリア
5.5.2.5 スペイン
5.5.2.6 その他のヨーロッパ
5.5.3 アジア太平洋
5.5.3.1 中国
5.5.3.2 日本
5.5.3.3 インド
5.5.3.4 韓国
5.5.3.5 オーストラリア
5.5.3.6 その他のアジア太平洋地域
5.5.4 中東・アフリカ
5.5.4.1 GCC
5.5.4.2 南アフリカ
5.5.4.3 その他の中東・アフリカ地域
5.5.5 南米アメリカ
5.5.5.1 ブラジル
5.5.5.2 アルゼンチン
5.5.5.3 その他の南米アメリカ
6. 競争環境
6.1 市場集中
6.2 戦略的な動き
6.3 市場シェア分析
6.4 企業プロフィール(グローバルレベルの概要、市場レベルの概要、主要事業セグメント、財務、従業員数、主要情報、市場ランク、市場シェア、製品・サービス、最近の動向の分析を含む)
6.4.1 F. Hoffmann-La Roche AG
6.4.2 Bristol Myers Squibb Company
6.4.3 Johnson & Johnson Services Inc. (Janssen)
6.4.4 Merck & Co., Inc.
6.4.5 AstraZeneca PLC
6.4.6 Novartis AG
6.4.7 Pfizer Inc.
6.4.8 Amgen Inc.
6.4.9 AbbVie Inc.
6.4.10 GSK PLC
6.4.11 Takeda Pharmaceutical Company Limited
6.4.12 Astellas Pharma Inc.
6.4.13 Gilead Sciences Inc. (Kite Pharma)
6.4.14 Seagen Inc.
6.4.15 Regeneron Pharmaceuticals, Inc.
6.4.16 BeiGene Ltd.
6.4.17 Exelixis, Inc.
6.4.18 Eli Lilly and Company
6.4.19 Celldex Therapeutics Inc.
6.4.20 Alaunos Therapeutics Inc.
*** 本調査レポートに関するお問い合わせ ***
